关于睡眠的治疗方法研究
Translational approaches to influence sleep and arousal
Abstract
睡眠和唤醒机制的紊乱在神经精神疾病中很常见,如精神分裂症、创伤后应激障碍、焦虑和情感障碍、创伤性脑损伤、痴呆和物质使用障碍。
调节睡眠和唤醒的非侵入性脑刺激技术是安全的,显示出潜力,但需要进一步发展才能广泛应用。侵入性病毒载体和脑深部刺激方法也处于起步阶段,但可能用于在严重的神经和精神疾病中调节睡眠和唤醒。
这些操作可以通过促进睡眠对记忆巩固、毒性代谢产物清除、代谢和免疫功能的恢复作用,以及通过减少过度兴奋,对广泛的神经和精神疾病的治疗产生积极影响。
Introduction
把干预措施分为四部分:行为方法、药物治疗方法、非侵入式刺激方法和侵入式刺激方法
关注重点是可以促进健康 睡眠-觉醒 周期并促进或纠正不同 睡眠-觉醒 状态下发生的特定皮层电振荡的方法
美国国立卫生研究院国家促进转化科学中心将转化(translation)定义为“将实验室、诊所和社区的观察转化为改善个人和人群健康的干预措施的过程——从诊断和治疗到医疗程序和行为干预”。
基础科学→诊疗方法
可通过转化方法靶向的睡眠-觉醒控制回路和机制的简要概述
EEG/EMG 是人类和哺乳动物睡眠评定的黄金标准。
清醒的特征是脑电中的低振幅、快速(>4 Hz)活动和肌电图中的高骨骼肌张力增加。脑电的低振幅、快速活动由脑干、中脑和下丘脑的上升唤醒系统的自我增强网络控制,该网络刺激投射到皮层浅层和深层的中线和层内丘脑神经元,以及几种不同类型的投射到皮层的基底前脑神经元。这些上升唤醒系统(包括胆碱能和胺能系统(去甲肾上腺素、血清素、多巴胺、组胺))直接投射到新皮层,也促进了典型的唤醒皮层的快速活动
肌张力,是肌细胞相互牵引产生的力量。肌肉静止松弛状态下的紧张度称为肌张力。
在从清醒到睡眠的过渡开始时,脑电开始降低,显示出更多的后部的α(8-14 Hz)和前部的θ(4-8 Hz)活动。
随着睡眠的加深,丘脑网状(TRN)和丘脑皮质(TC)神经元由于兴奋性输入的撤回而变得更加超极化,不同的脑电特征变得明显。TRN和TC神经元爆发放电的波动和减弱模式导致在皮层中记录睡眠纺锤波(11-16 Hz)产生,这是人类第2阶段睡眠的特征。TRN神经元的同步爆发放电,特别是含有钙结合蛋白小白蛋白的亚群,通过在TC神经元中产生快速超极化而导致睡眠纺锤体,从而导致反弹爆发,反弹爆发被传递到皮层并返回TRN,从而导致新的振荡周期。
随着睡眠的进一步加深,慢波活动(0.5–4 Hz)在脑电图中占主导地位,这是主要由皮层产生的慢波(0.5–1.5 Hz)和丘脑产生的δ(1.5–4 Hz)。慢波(0.5–1.5 Hz)起源于额叶皮层,并作为行波向后移动,协调其他NREM睡眠振荡的时间。δ振荡(1.5–4 Hz)主要由丘脑产生,这是由于TC神经元中固有电压门控通道的相互作用,这些通道随着超极化的增加而变得活跃。睡眠期间的慢波活动(0.5–4 Hz),特别是在delta2(2.5–3.5 Hz)波段,是睡眠强度的标志,并在睡眠剥夺或中断后增加。
快速眼动睡眠(REM sleep)——一个和梦境相关的睡眠。此阶段脑电类似于清醒状态,但骨骼肌张力是缺失的。胆碱能和谷氨酸能脑干神经元被认为是促进REM/REM活动的神经元,而去甲肾上腺素能和5-羟色胺能神经元抑制REM/关闭REM。除了快速眼动本身,快速眼动状态的几个特征也很重要。脑桥、丘脑外侧膝状体核和枕叶皮层可以记录到被称为PGO波的高振幅电事件,这表明它在视觉梦中起作用。在海马体和其他大脑区域也可以观察到这些事件的相关性,并可能参与快速眼动睡眠期间发生的突触可塑性/记忆巩固过程。高振幅连续θ(4-8 Hz)活动是啮齿类动物快速眼动睡眠的典型特征,与记忆巩固有关(Buzsaki,1989),但人类的θ活动往往更为间歇性,频率略慢。
Translational approach
行为方法
认知行为疗法(CBT-I)——主要包括五方面的内容:睡眠卫生教育、刺激控制、睡眠限制、松弛疗法、认知治疗。
药物方法
- 苯二氮卓类和非苯二氮卓类受体突触$GABA_A$受体的变构激动剂
- 突触外$GABA_A$受体激动剂
- $GABA_B$受体激动剂
- 食欲素受体拮抗剂
- 食欲素受体激动剂
- 单胺类药物
- 组胺能药物
- 腺苷受体拮抗剂
- 褪黑素和褪黑素受体激动剂
- 潜在的新药靶点
非侵入式刺激方法
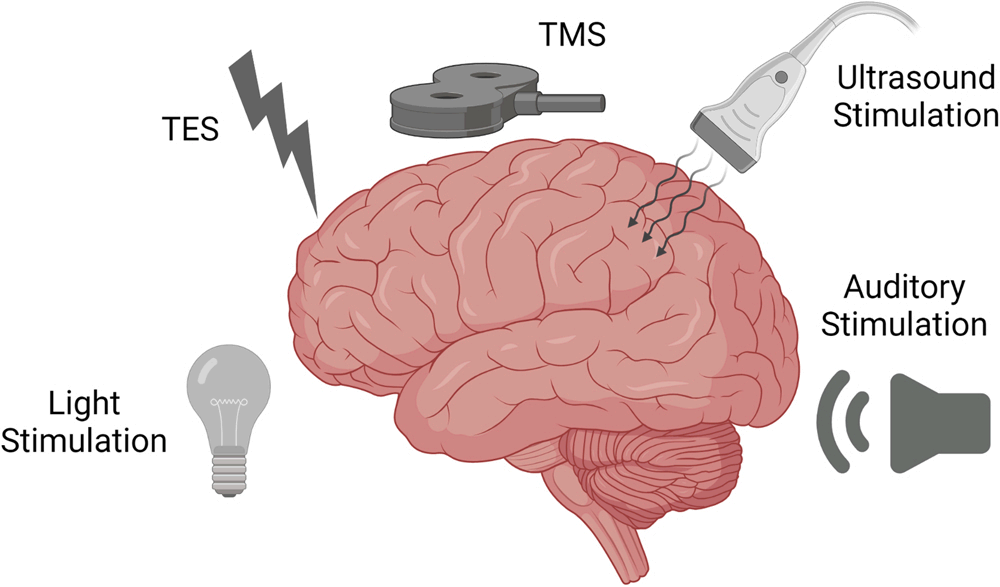
1、经颅电刺激
包括三种:
- tDCS:经颅直流电刺激
- tACS:经颅交流电刺激
- osc-tDCS:为了同时受益于tDCS的直接影响和tACS的节律影响,直流电和交流电可以组合形成极化交流电。由此产生的刺激方法通常被称为振荡经颅直流电刺激(osc-tDCS)
当使用θ频率时,Anodal osc-tDCS会导致健康受试者嗜睡,并且在该频率范围内比在δ频率范围内更有效地增强内源性δ活动。
(Electrical stimulation of the frontal cortex enhances slowfrequency EEG activity and sleepiness)
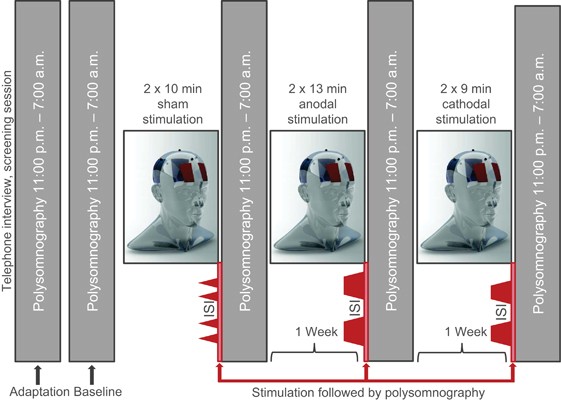
两个实验Exp.1和Exp.2,每个实验10位被试。
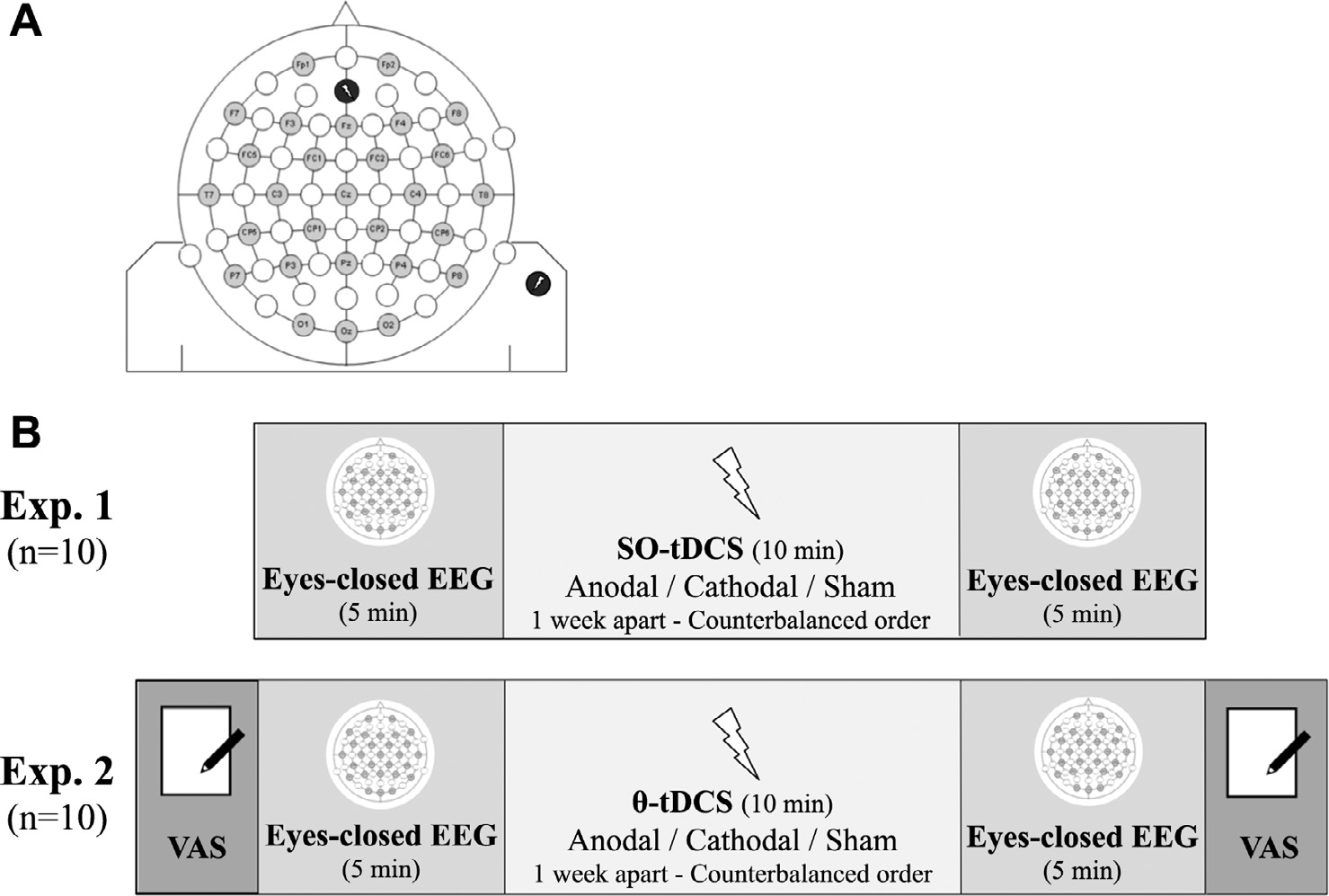
VASgv(Monk,1987)是一种主观警觉性的衡量标准,它将四个量表(警觉、嗜睡、疲倦和努力)的得分结合起来,获得0到40之间的全局活力得分。
通过连接到电池操作的刺激器系统(BrainTIM,EMS medical)的两个导电橡胶圆形电极(直径:1.2cm)施加刺激。具有正极性的电极(代表刺激电极)被放置在Fz前方1cm处(图1A),而具有负极性的电极,即参考电极,被放置在右三角肌上。
刺激10min,电流强度范围从最小0 mA到最大0.6 mA(最大电流密度:0.531 mA/cm2)。
SO-tDCS:0.8Hz;θ-tDCS:5Hz
结果:与0.8Hz相比,5Hz的阳极刺激与右前额叶区域的δ功率增加有关,与伪刺激相比,与主观嗜睡增加有关。
在一项针对失眠患者的小型研究中,为期一个月的tACS治疗也降低了睡眠开始潜伏期(SOL)。
(Effect of Transcranial Alternating Current Stimulation for the Treatment of Chronic Insomnia: A Randomized, Double-Blind, Parallel-Group, Placebo-Controlled Clinical Trial)
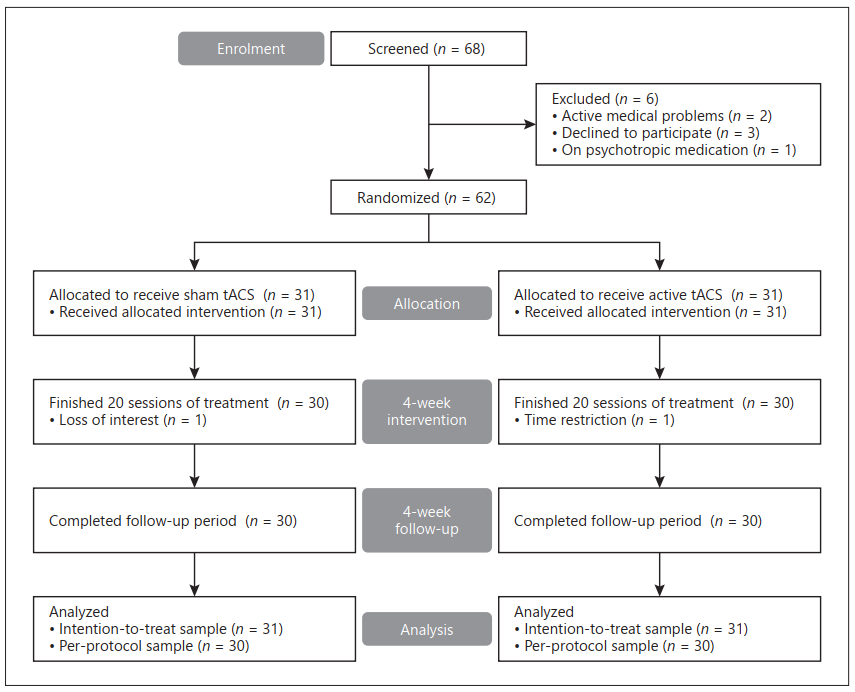
每名患者在连续4周的固定时间接受20次tACS干预,从周一到周五每天一次;周末休息。每次治疗持续40分钟。三个Nexalin电极应用于头皮:一个4.45×9.53cm的电极,放置在前额上(10/20国际放置系统中的Fpz、Fp1和Fp2。两个3.18×3.81cm的电极放置在耳朵后面的乳突区域(见在线补充3)。在活动组中施加具有77.5Hz的频率的15mA电流水平,而在假手术组中不施加刺激。

结果:在试验过程中,与伪刺激组相比,活动组的PSQI总分显著降低,SOL(睡眠开始潜伏期)缩短,TST(总睡眠时间)增加,睡眠效率提高,睡眠质量改善(p<0.05或p<0.001)。事后分析显示,与假治疗组相比,除了日常障碍外,活动组症状有所改善,在4周干预结束时,并且在4周随访时所有症状都有显著改善。研究期间未发生不良事件或严重不良反应。
Frase et al. (2016)通过在额叶放置两个阳极,在顶叶放置两个阴极,为健康受试者提供tDCS。参与者在3个晚上接受阳极、阴极和假刺激,每个晚上间隔1周,并在每次刺激后的晚上进行多导睡眠图记录,以测量他们的TST。然而,与阴极和假刺激设置相比,阳极刺激降低了TST,而阴极刺激没有增加TST。
(Modulation of total sleep time by transcranial direct current stimulation (tdcs).)
Frase et al. (2019)在19名失眠患者身上测试了相同的tDCS蒙太奇和方案。在本实验中的任何刺激条件下都没有发现TST的变化。
(Differential effects of Bifrontal tdcs on arousal and sleep duration in insomnia patients and healthy controls.)
因此,单独的tDCS似乎不能有效地增加TST。
Saebipour及其同事在两个晚上的受试者内部设计中,对6名失眠患者进行了0.75 Hz osc-tDCS和假刺激。两个阳极放置在额叶上,两个阴极放置在乳突上。一旦受试者进入他们的第一阶段2睡眠,就给予刺激或假动作。分析刺激期后参与者睡眠的多导睡眠图记录,发现以下改善:
睡眠效率提高9%,这是由总睡眠时间与总卧床时间的比率定义的,与从睡眠到清醒的第二阶段过渡减少12%有关。他们发现,与伪刺激相比,osc-tDCS使深度第3阶段NREM睡眠的持续时间大幅增加。平均而言,osc-tDCS使NREM第3阶段的持续时间增加了33分钟,使NREM的第1阶段减少了22分钟,使得第1阶段的睡眠和睡眠开始后的清醒时间一起减少了55.4分钟。
(Slow oscillating transcranial direct current stimulation during sleep has a sleep-stabilizing effect in chronic insomnia: A pilot study )


慢速振荡经颅直流电刺激模式。刺激电流在0和260μA之间振荡,每4秒振荡三次,影响0.75-Hz的刺激模式。
将阳极放置在F3和F4上,将阴极放置在乳突上,使用具有8mm直径的一次性预凝胶粘合剂Ag/AgCl电极的夹子连接器。
2、经颅磁刺激
在一项开创性的研究中,Massimi等人(2007)使用TMS来增加健康受试者皮层的缓慢皮层振荡和睡眠纺锤波。
在NREM睡眠的第2阶段期间,沿前后轴的四个中线皮质部位(后顶叶、感觉运动、辅助运动和前嘴运动)以大约0.8Hz的频率传递刺激电流。他们的TMS montage成功地增加了纺锤波的振幅,并触发了SWA(慢波活动),SWA直接从TMS线圈的位置开始,并沿着皮层向各个方向扩散。
结果:TMS有可能通过在皮层中诱导SWA来触发纺锤波并增加慢波睡眠阶段的持续时间。诱发的慢波会导致睡眠加深和脑电图慢波活动增加(0.5–4.5 Hz),这被认为在大脑恢复和记忆巩固中发挥作用。
(Triggering sleep slow waves by transcranial magnetic stimulation)

在非快速眼动(NREM)睡眠期间,皮层神经元的膜电位每隔一秒左右在去极化向上状态和超极化向下状态之间交替。当这些振荡接近同步并涉及大部分皮层时,它们在脑电图中很容易被视为大振幅的慢波,通常超过100μV,这构成了正常情况下大脑产生的最大电位。慢振荡(SO)起源于局部,并以行波的形式在皮层上扩展,每晚重复数百次。皮层神经元上下状态的交替被认为与记忆巩固、突触稳态和睡眠恢复功能有关,因此可靠触发慢波的能力可能具有重要应用。
在受试者进入NREM睡眠第2阶段的巩固期(5分钟)后,我们开始探索在不同皮层部位以增加的强度触发慢波。
让失眠障碍参与者长期接受更多rTMS治疗的方案可能更有效地对抗睡眠障碍。
Jiang等人(2013)将120名失眠患者平均分为三组。选择了白天嗜睡程度高、入睡和保持睡眠困难的参与者。第一组在2周内每天接受rTMS治疗,而第二组和第三组在同一时期分别接受药物治疗和心理治疗。药物治疗组每晚服用2 mg 艾司唑仑片,心理治疗组接受认知行为治疗。作者在第一组受试者的右背外侧前额叶皮层(DLPFC)上使用了1 Hz rTMS。在其他阳性结果中,研究人员在分析了两周治疗后夜间多导睡眠图测试的数据后,发现所有三个条件组的TST都显著增加。此外,三组患者的睡眠效率均显著提高。这些结果表明,rTMS在增加总睡眠时间方面至少与药物和心理治疗一样有效。
(Efficacy of Repetitive Transcranial Magnetic Stimulation in the Treatment of Patients with Chronic Primary Insomnia)
与伪刺激相比,背外侧前额叶皮层重复tDCS后,重度抑郁症和失眠患者的总睡眠时间和睡眠效率也有所增加
(The effects of repeated transcranial direct current stimulation on sleep quality and depression symptoms in patients with major depression and insomnia.)
方法:对患有严重抑郁症和失眠的成年人进行了一项随机双盲研究。我们随机分配患者在常规治疗中加入tDCS或假tDCS。随机分组后,共治疗了90名患者。我们将47名患者分配到tDCS组,43名患者分配给假tDCS组。tDCS治疗程序包括对背外侧前额叶皮层(DLPFC)进行20次2-mA刺激,持续30分钟,然后每周进行四次治疗。将阳极和阴极电极分别放置在左侧和右侧DLPFC上。我们在第1天和第28天记录了抑郁自评量表(SDS)、焦虑自评量量表(SAS)、匹兹堡睡眠质量量表(PSQI)和多导睡眠图(PSG)。
结果:研究证明了tDCS对MDD和失眠患者的睡眠质量和抑郁症状的影响。这些结果表明,tDCS刺激不仅改善了抑郁症和焦虑症的症状,而且对MDD患者的睡眠质量也有积极影响。对于抑郁症和失眠患者来说,tDCS刺激可能是药物的一个很好的补充。

值得注意的是,这项研究中的所有90名参与者都在接受依西酞普兰和佐匹克隆的联合药物治疗,这两种药物分别用于治疗抑郁症和失眠。
3、听觉刺激
许多人使用白噪音或自然声音(如雨)的录音来帮助入睡,尽管其有效性的证据似乎很弱(Riedy等人,2021)
研究人员能够使用有节奏的声音刺激或定时到持续睡眠振荡阶段的刺激来影响睡眠结构(Bellesi等人,2014;Malkani和Zee,2000,Wunderlin等人,2021)。
听觉刺激在NREM过程中非常有效地诱导K复合波和慢振荡,大多数听觉刺激研究的目标是增加慢波活动或纺锤体慢波复合物(Malkani和Zee,2020)。
然而,听觉刺激也可以被定制为在特定频率下诱导睡眠纺锤波(Antony和Paller,2017)或在快速眼动睡眠期间诱导PGO波 (Bellesi et al., 2014; Malkani and Zee, 2020; Wunderlin et al., 2021)
4、内耳前庭刺激
前庭器官是指内耳迷路中除耳蜗外,其余的三个部分(半规管、椭圆囊和球囊),是人体对自身运动状态和头在空间位置的感受器。当机体进行旋转或直线变速运动时,速度的变化(包括正、负加速度)会刺激三个半规圆或椭圆囊中的感受细胞。当头的位置和地球引力的作用方向出现相对关系的改变时,就会刺激球囊中的感受细胞。
在人类研究中,在短暂的小睡(Bayer et al.,2011)或整晚(Perrault et al.,2019)中躺在摇床上(0.25 Hz)会加速入睡阶段,带来NREM睡眠振荡(0.5–5 Hz的慢波活动和睡眠纺锤波),并增强睡眠依赖性记忆巩固,这一效应与快速睡眠纺锤波的增加有关(Perraolt et al.。2019)。
因此,摇摆可能是促进睡眠和NREM睡眠振荡的有效方法,这对睡眠依赖性记忆的形成很重要。
前庭刺激的另一种形式是迷走神经刺激的非侵入性形式。耳刺激已被研究为失眠的潜在治疗方法,尽管在反应性方面存在相当大的个体间差异(Jiao et al.,2020)。
5、光刺激
睡眠和昼夜节律研究的开创性进展之一是发现了一种独特的视网膜神经节细胞亚群(本质上是光敏的),它表达光色素黑视蛋白,并向昼夜节律的中心起搏器视交叉上核发出信号(Foster et al.,2020)。
当夜间或夜间暴露大量光线时,室内灯光,尤其是靠近眼睛的屏幕可能会扰乱睡眠(Heo等人,2017;Tam等人,2021)。因此,换红灯和屏幕或使用蓝色遮挡眼镜可以促进健康的睡眠和昼夜节律(Wirz Justice,2010)。
相反,白天早些时候明亮的蓝光有利于唤醒和随后的夜间睡眠,也有利于情绪,尤其是对于那些患有季节性情感抑郁症或冬季远离赤道的人。
6、清醒阶段γ频段40Hz刺激
大脑激活状态通常表现出β(15-30 Hz)和γ(30-80 Hz)波段高频脑电图活动的功率增加,这是由基底前脑和丘脑中的唤醒系统的增强介导的。清醒时皮层活动的增加会导致更活跃区域的睡眠振荡波增加。
因此,广泛增加大脑活动的操作可能会增加随后的睡眠。
最近对携带阿尔茨海默病相关病理基因的转基因小鼠进行的有趣研究表明由40赫兹的光脉冲和/或听觉刺激引起的同步40赫兹活动的增加可能对清除阿尔茨海默病中与病理有关的蛋白质和改善认知有有益的作用。
在最近的一项小型临床研究中,与8名假对照受试者相比,14名轻度至中度AD患者在6个月内每天接受1小时40赫兹的感觉刺激后,测量显示睡眠改善(通过使用手腕佩戴的活动记录仪(ActiGraph GT9X)连续监测AD患者的活动)。
(Sensory-Evoked 40-Hz Gamma Oscillation Improves Sleep and Daily Living Activities in Alzheimer’s Disease Patients)
挑战
利用这项技术并改善健康人和睡眠障碍患者的睡眠仍然面临的挑战是为非侵入性大脑刺激建立一个坚实的框架。除其他外,仍需研究一些关键变量,以确定如何以最安全有效的方式使用非侵入性刺激,这些变量包括刺激持续时间、目标大脑区域、最佳刺激时间以及刺激强度和频率。
此外,对于那些涉及睡眠振荡调制的技术,理想情况下,刺激需要部署在正在进行的振荡的正确相位,因此需要实时睡眠振荡检测的进一步工程和软件进步,才能广泛有效地部署这些技术。
侵入式刺激
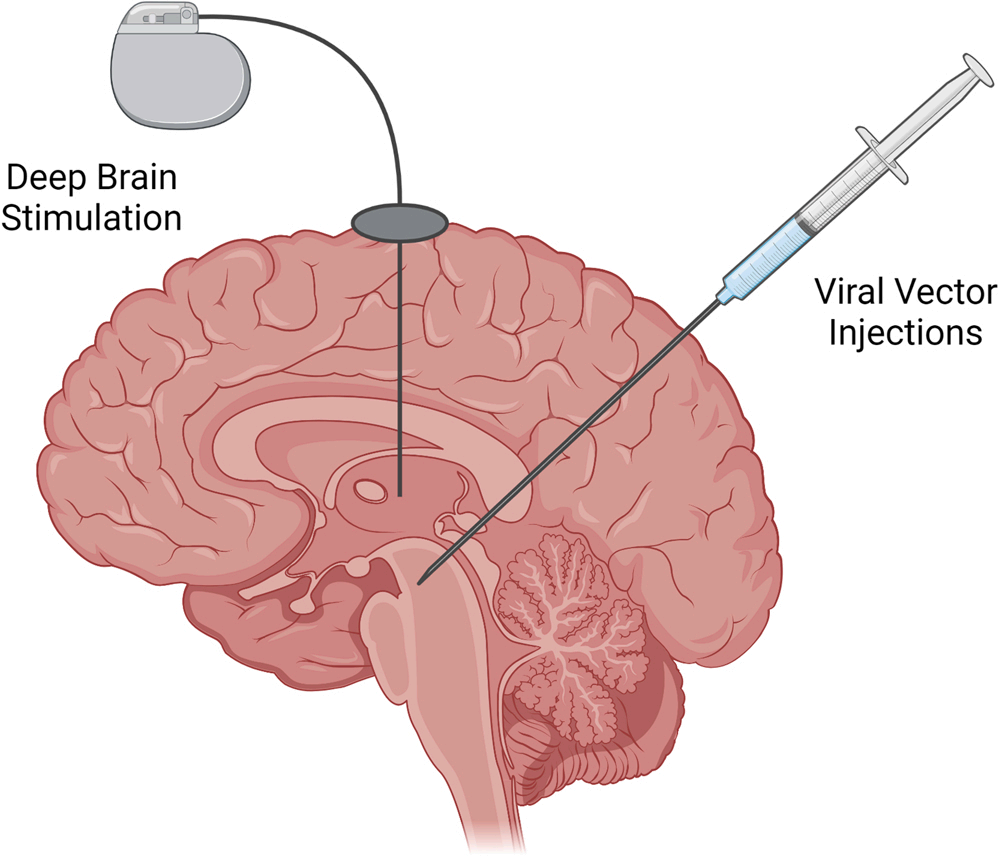
包括脑深部电刺激、迷走神经刺激、病毒载体介导和移植方法等。
越来越多的脑深部刺激研究以基底节核为目标,试图改善帕金森病的睡眠异常,如失眠、睡眠碎片和白天过度嗜睡(EDS)。这些研究中的大多数针对丘脑底核,并报告了使用主观睡眠参数的总体积极结果,在少数情况下还使用了多导睡眠图。
(Deep brain stimulation and sleep-wake functions in Parkinson’s disease: a systematic review.)



