4mA经颅电刺激对运动序列学习的鲁棒增强
Cohen’s d: 效应量(对效应量进行标准化)之一,表明两个均数的前后差异。
t检验是通过比较不同数据的均值,研究两组数据之间是否存在显著差异。
p值是一组数据的均值(以及比这种数据更极端的数据的均值)在另一组数据的均值所代表的总体中出现的概率。当p值越小,说明两者差异越显著,因为这说明一组数据是另一组数据所代表的总体中的样本的可能越小(因为两者的均值差异)。
Highlights
- tDCS导致了并发学习的持久提升,其影响大小为Cohen’s d=0.7。
- 随后的学习也得到了改善,表明这是一种元学习形式
- 对行为的详细分析表明,tDCS对序列整合有影响。
- 通过4+4个电极中的每一个都具有1mA的新型电极蒙太奇具有良好的耐受性
Abstract
背景和目的:
用2mA经颅直流电刺激(tDCS)进行的运动学习实验产生了好坏参半的结果。我们假设,如果运动皮层上有足够高的场强,tDCS将促进运动学习。
方法:
在一项单盲、受试者之间的设计中,72名健康的右撇子参与者接受了4mA的阳极或阴极tDCS,同时他们学习使用非支配手(不熟练使用的手)进行一系列按键,持续约12分钟。 阴极刺激作为感觉的主动控制。一个单独的伪刺激组建立了基线表现。分析了训练和休息期间的收获(称为微在线和离线学习)。使用fMRI(功能磁共振成像)在运动皮层上识别刺激目标。在对单个电流模型进行优化后,我们为所有108名参与者选择了一个蒙太奇,其中4个额叶电极和4个顶叶电极,每个电极的电流为1mA。
伪刺激应该与实际刺激相同,只是目标接收到的真实磁场不同。对于刺激线圈,在外观,声音和用法上应该是相同的。在临床和科学研究中,TMS伪刺激试验是验证TMS真实刺激效果的重要手段。
结果:
我们发现阳极刺激显著提高了表现(Cohen’s d=0.7)。表现的提升至少持续了一个小时。对于新序列和另一只手的后续学习也得到了改进。并发tDCS增强了微离线学习,而后续学习依赖于微在线收益。活动组的感觉评分具有可比性,未超过中等水平。 与替代蒙太奇相比,新的电极蒙太奇在刺激强度和头皮感觉之间实现了更好的权衡。
结论:
目前的范式在4mA时显示出可靠的行为效应,并且耐受性良好。它可以作为未来运动学习和tDCS研究的一个实验。
Intro
经颅直流电刺激(tDCS)已被证明会影响神经元的兴奋性,一些人认为这种效应可能是由于突触效率的调节。我们已在体外确定直流电刺激(DCS)可与内源性可塑性机制相互作用,以促进突触增强。这意味着tDCS可能会促进那些已知学习来自突触效能变化的任务中的学习,包括人类和啮齿动物的运动技能学习任务。事实上,许多人类行为研究将tDCS与运动学习计划配对,以增强学习效果。然而,他们产生了混合的结果。
- 几项研究报告,初级运动皮层(M1)或小脑上的同时阳极刺激可增强外显运动序列学习。
- 其他人发现,2mA时的小脑tDCS不会影响学习表现,也不会改变功能磁共振成像(fMRI)记录的神经元活动
- 还有一些人报告说,当刺激强度增加到4mA时,运动学习表现单调增加,但未能控制随着刺激强度增加的感觉
总的来说,我们仍然缺乏一种可靠的行为方法来评估tDCS调节运动学习的功效。
这种缺乏可靠性的部分原因可能是刺激强度不足。用传统的tDCS在皮质表面感应的电场小于1V/m。 我们假设,通过将电流强度从传统的2mA(H1)增加到4mA,可以通过并发tDCS可靠地增强运动序列学习。此外,我们预计这种增强效应将持续一段时间(H2)。根据我们先前的体外树突状细胞研究,我们假设持续的tDCS效应特异于与刺激配对的半球(H3),特异于与刺激配对的序列(H4)
我们使用一个经典的运动序列学习任务,即“手指敲击任务”(FTT)来测试这一点。 这项任务中的表现提升与M1的功能变化相关。 当与同时应用的阳极刺激相结合时,我们预测任务表现会提高。刺激特别针对“hand-knob”区域,我们用fMRI对其进行定位。我们优化了高清晰度tDCS(HD-tDCS)电极的位置,以最大限度地提高该目标的强度,同时通过4对电极分配电流,每对电极通过1mA。 因此,这种设置的好处有两个:更好的空间定位,以及减少头皮上电流扩散带来的不适。为了控制4mA时不可避免的感觉效应,我们比较了两个不同组中的阳极刺激与阴极刺激,以及无刺激对照组。 我们发现,在刺激后持续1小时的阳极刺激下,性能得到了明显的提高,并且在刺激后学习新序列方面也有所提高。
Methods
Summary
我们旨在通过FTT测量tDCS的行为调节效应。 首先,我们确定了最佳电极位置,以最大化学习任务期间最活跃的大脑区域感应的电场。 通过对10名受试者的小样本进行fMRI,我们将刺激目标定位在M1的“hand-knob”区域,将其作为目标输入到单个大脑的电流模型中,以生成一个公共电极蒙太奇, 该蒙太奇将在运动序列学习任务期间用于所有受试者(N=108)。蒙太奇将由4对电极组成,4个阳极加4个阴极(4+4)。对于学习任务,受试者分为三组(每组36人),分别接受阳极刺激、带阴极刺激的主动假动作和无刺激。 在这里,“阳极”刺激被定义为靶皮质结构上的内向电流,而“阴极”刺激中极性反转。在FTT表演(H1)期间进行刺激,然后在一小时的休息后重复FTT,以确定跨时间(H2)、大脑半球(H3)和不同序列(H4)的携带效应。
Target Location
在10名健康成人(2名女性,8名男性,年龄范围=18-55岁,平均=±SD=24.2±6.12岁)的成像队列中确定了靶点位置和电极放置。
在fMRI任务中,参与者每只手拿着一个4按钮响应板,每个手指放在一个按钮上。在电脑显示器的提示下,参与者一次用一只手按30秒手指交替设置的按钮,两手轮流,两组之间休息30秒。
为了模拟FTT,在每组中,被试从小指向食指依次按下按钮,并在30秒内尽可能多次重复该顺序。在fMRI期间,每只手完成10组,总共约10分钟。在AFNI(功能神经图像分析)中计算了手指敲击过程中血氧水平相关(BOLD)信号强度与休息期间信号的对比度(分别针对左手和右手)。
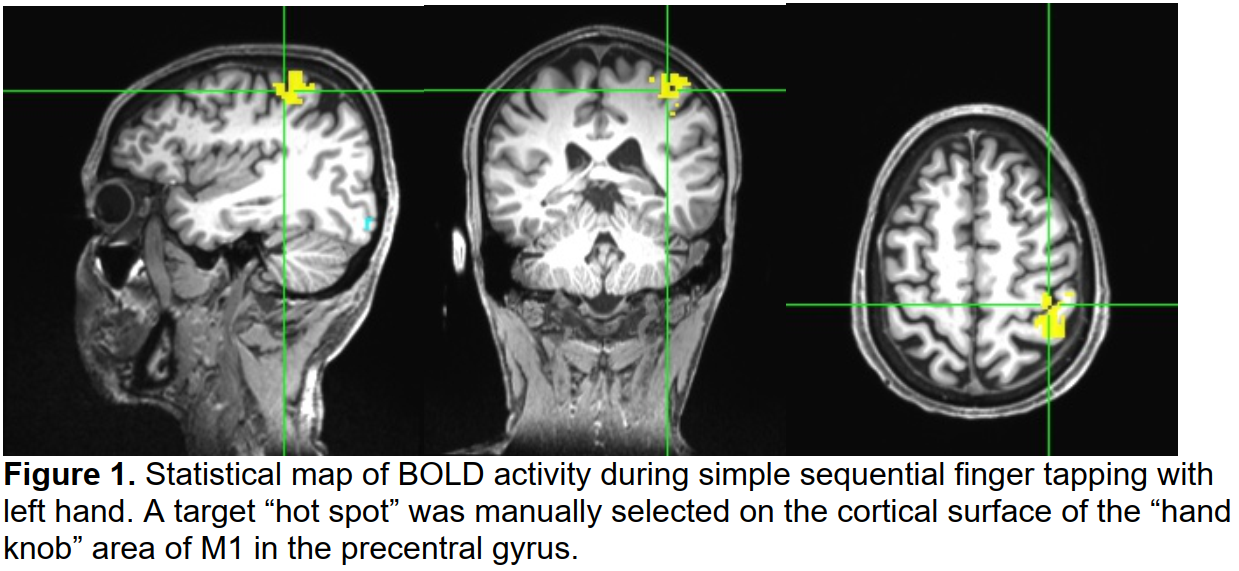
受试者级预处理包括:切片时间校正、去噪、将功能时间序列与目标体积进行共配准,并将解剖数据与共配准数据对齐,对距离目标体积大于1mm的运动数据进行截尾,通过对大脑提取的数据应用5mm高斯核来平滑功能磁共振成像,在0.01和0.1Hz之间进行带通滤波,以及去趋势化时间序列以校正信号漂移。为了从信号中去除伪影,来自白质和脑脊液的时间序列数据以及来自配准的6个运动回归被纳入AFNI的干扰回归“3dDeconvolve”函数,该函数将数据建模为输入刺激(左/右/静止手指敲击块),并生成回归β系数的统计图和系数显著性的t统计量。对得到的t统计量图进行阈值化,以确定在连续手指移动期间最活跃的像素(图1用于左手)。我们关注左手(右半球),因为序列学习任务将针对右撇子参与者的非支配手。 使用FreeSurfer进行皮层分割,将活动区域缩小到中央前回的“hand-knob”区域,并在这些边界内手动选择具有最大或接近最大统计值的单个体素作为目标。
Electrode Placement
对于成像队列中的每个参与者(N=10),我们首先使用ROAST生成电流模型,头部模型由每个受试者的T1加权解剖MRI自动生成。然后,使用该模型确定在所需方向上使目标位置处的电场最大化的电极布置(最大场强法)(图2a-b中一个受试者的示例)。 为了确定所需的场方向,我们目视检查了解剖图像,并在轴向扫描中确定了目标处皮质表面的法向量。为了在不需要昂贵的单个磁共振成像的情况下实现结果的再现性,我们创建了一个蒙太奇,为成像队列中的所有10名参与者提供了合理的结果。为此,我们首先选择一个共同的期望场方向作为所有10名受试者的平均方向(前/后方向33度,水平/轴向11.3度)。 然后,我们为每个参与者确定了电极蒙太奇,该蒙太奇最大化了单个目标处该期望方向的场幅度。我们将总电流限制为4mA,每个电极的最大电流为1mA。这将始终提供4个阳极和4个阴极,但通常在每个受试者的不同位置。候选位置在10-10国际系统上。
为了决定一个蒙太奇,我们计算了“投票”选择给定电极的频率(图2c)。“投票最多”的四个电极最终被选择,以产生最终蒙太奇(图2d),阴极位于F4、F2、AF4和Fz上,阳极位于P4、CP4、CP2和P2上。参考电极放置在CP3处(无电流)。
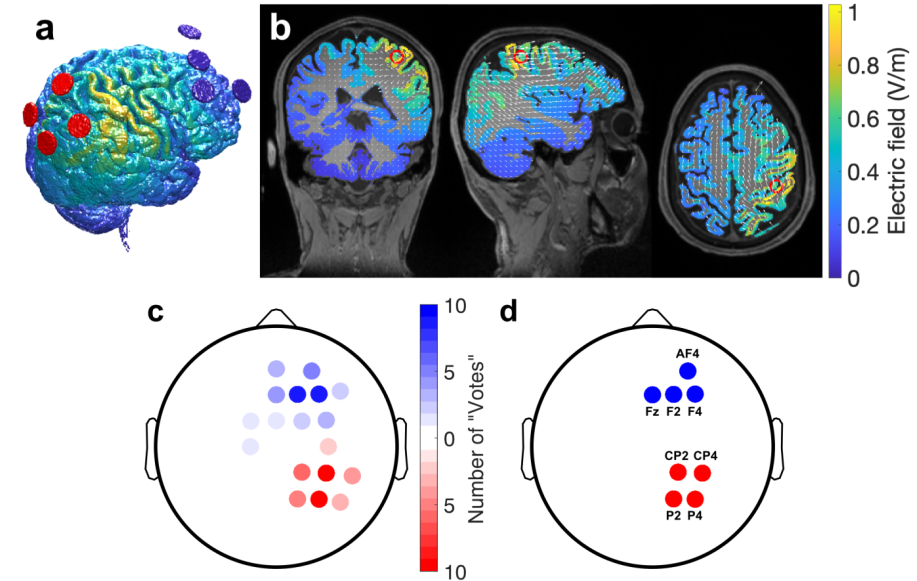
Tally of how often an electrode location (on the 10-10 system) was selected by the optimization routine in ROAST for the 10 individual subjects models and
targets (red: anodes, blue: cathodes)
Stimulation and Behavioral Task
Participants
对于运动序列学习任务,108名健康的右利手成年人(52名女性,56名男性,年龄范围=18-55岁,平均±SD=24.6±6.42岁)在纽约城市大学IRB的批准下,提供了参与本研究的书面同意。所有受试者都完成了整个实验过程,尽管他们在实验过程中的任何时候都因不适而被允许退出。
Experimental Design
在单盲设计中,被试被随机分配到阳极或阴极刺激组(每组n=36)。阳极刺激是一种活跃的兴奋状态。阴极刺激被用作伪刺激,因为在4mA时,感觉是明显的,无法合理伪装。为了建立学习的基线水平,我们随后测试了一个对照组,其中所有受试者均未获得刺激(n=36)。然而,为了尽可能接近地模拟刺激环境,无刺激对照组的参与者接受了与其他两组相同的程序,包括戴帽子和在头皮上涂抹凝胶,并告知他们可能受到刺激。
Procedure
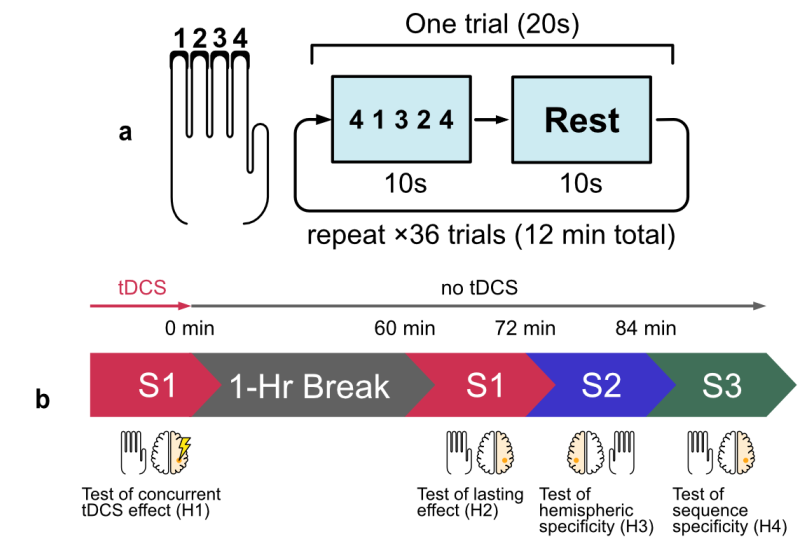
参与者坐在电脑显示器和键盘前,键盘上有4个相邻的键,从左到右分别标记为“1”、“2”、“3”和“4”。在每个FTT部分开始时,要求参与者将手(左或右)放在标记的键上(图3a)。任务的每次迭代包括36次连续试验,每次20秒长。在每次试验的前10秒内,监视器上的MATLAB图形用户界面上出现了5位数字序列。参与者被要求按屏幕上显示的数字对应的键,从左到右按顺序,“尽可能快、准确”。他们要在这10秒内尽可能多地完成这个序列,然后是10秒的休息间隔。在FTT的一次迭代中,在所有试验中显示相同的序列。
实验分为两个阶段:测试假设H1的主要任务阶段和测试假设H2–H4的后续阶段(图3b)。在初始阶段,参与者在进行序列S1(4-1-3-2-4)的FTT时同时接受刺激。刺激强度在30秒内逐渐增加,直到达到最大强度4mA(每个电极1mA),此时参与者开始任务。与FTT一样,tDCS持续12分钟,之后电流在30秒内急剧下降,回到零。刺激结束后立即给予视觉模拟量表(Wong Baker FACES疼痛量表)。受试者被要求在整个刺激过程中的各个点(刺激开始、中间和之后)对感觉水平进行评分,从0到10,10是最严重的。还从选项“无感觉”、“刺痛”、“刺痛/刺痛”、“瘙痒”、“灼烧”、“其他”中收集每个时间点的感觉质量评分。
在两次测试之间,参与者有一个小时的休息时间,可以自由参加任何活动。后续课程以重复S1开始,作为持续学习效果的测试。接下来,受试者使用相同的FTT学习序列S2(2-3-1-4-2)12分钟,但现在使用右手。这里的目的是测试对未受刺激的大脑半球是否有遗留效果。然后紧接着学习序列S3(3-4-2-1-3),再次在左手上进行12分钟的FTT。目的是测试在受刺激的手上是否有新序列的遗留效果。请注意,这些后续学习任务均未与tDCS配对。
Statistical Analysis
FTT性能的主要衡量标准是每次试验中完成的完全正确序列的数量。在这些完全正确的序列内以及在每个试验结束时不完整但正确的序列中,按键之间的平均时间间隔的倒数作为每个试验的敲击速度。使用两个样本进行组间比较,对整个12分钟任务绩效的平均绩效进行双尾t检验。
Results
阳极刺激改善运动序列学习
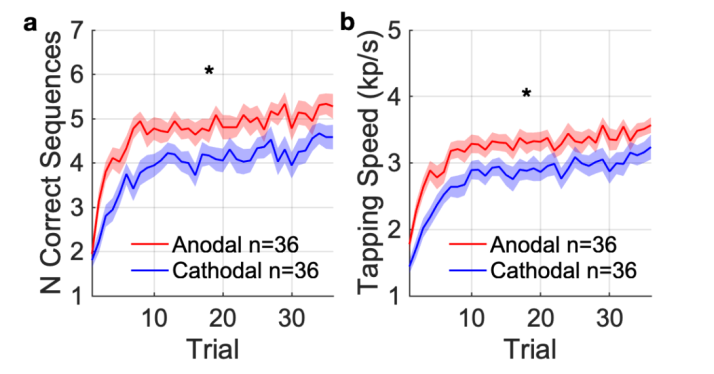
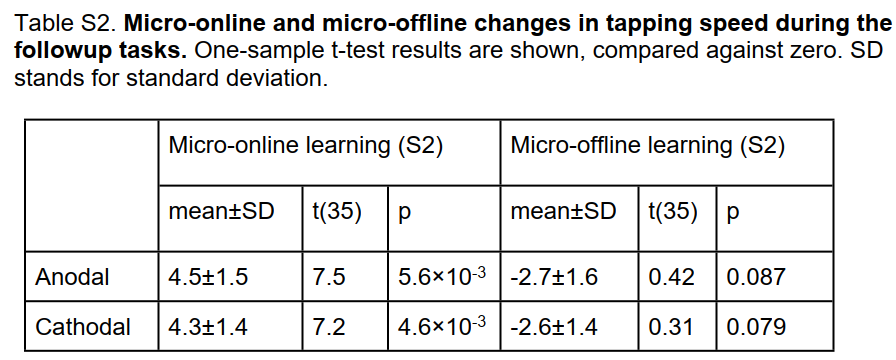
为了测试H1,主要结果测量是在同时刺激的所有试验中完成的正确序列的数量。36次试验的学习轨迹如图4a所示。通过对所有试验进行平均,我们获得了早期学习收益以及后期表现。在同时刺激期间,阳极组的平均正确序列数显著高于阴极组。与阴极组相比,阳极组在刺激期间的点击速度也显著更高。因此,阳极组中的受试者不仅在学习过程中正确完成了更多次序列,而且更快地完成了每个序列。
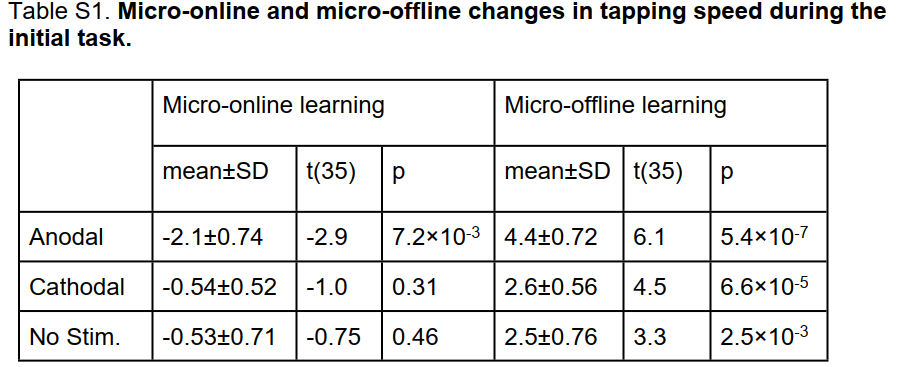
先前的研究表明,早期学习表现的提高并不发生在FTT的积极实践期间,而是发生在试验之间的休息期。这些分别称为微在线学习和微离线学习。目前的数据遵循相同的模式,前10次试验中的增益仅限于微离线学习(见图S6)。事实上,tDCS对学习的促进作用似乎完全局限于促进微离线学习(量化和统计测试表S1)。
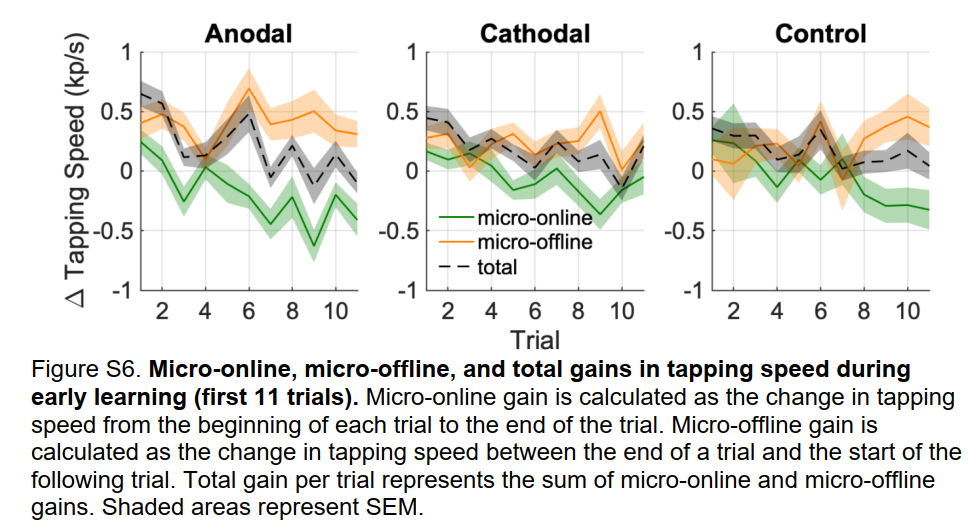
学习效果的提升持续时间至少1小时
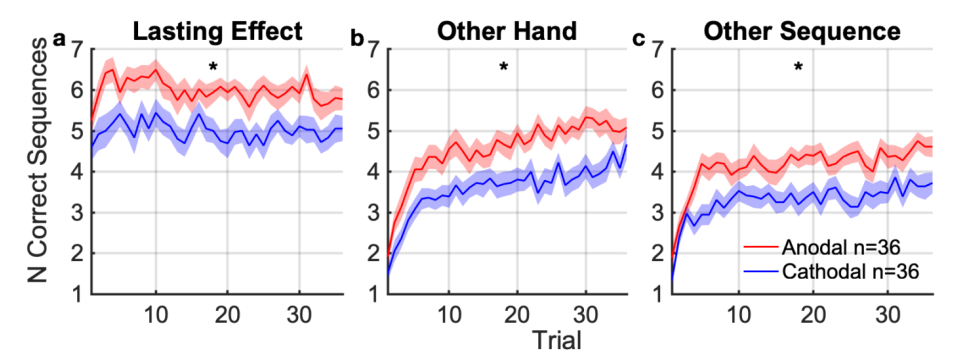
极性对表现的影响在刺激结束后持续一小时,与H2一致(图5a)。阳极组继续完成S1的次数比阴极组多(t(70)=3.13,p=2.56×10-3,图5a),但速度增加不再显著(t(70)=1.74,p=0.0861,图S1a)。
学习效果的提升扩展到未刺激的运动序列和未刺激的手
与H3和H4相反,刺激后的学习增益并不特定于受刺激的半球或序列。阳极组和阴极组之间的差异在刺激后72分钟右手开始学习(图5b)。正确序列的数量(图5b)和点击速度的趋势有显著差异(图S1b)。刺激后84分钟,阳极组和阴极组在学习左手新序列S3方面也存在显著差异(图5c)。提升表现在正确序列的数量和点击速度(图S1c)上。
刺激后84分钟,阳极组和阴极组在学习左手新序列S3方面也存在显著差异(图5c)。提升表现在正确序列的数量和点击速度(图S1c)上。
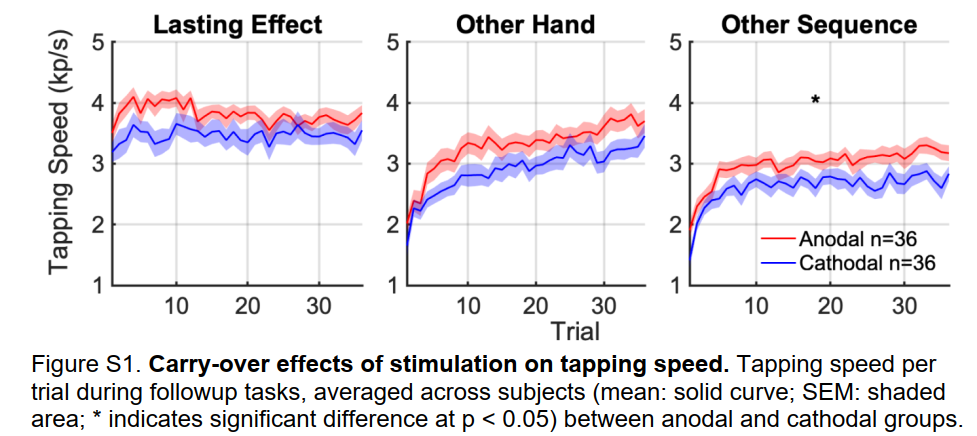
在所有刺激条件下,后续的学习效果完全限于手指敲击的时间段(表S2)。因此,这里的收益应该被描述为微在线学习-与我们在初始训练期间观察到的以及之前在这项任务中报告的情况相反。
阳极刺激比无刺激提供了表现的净收益
第三组的后续实验测试了无刺激对照组(图6)。阳极刺激组在正确序列方面优于对照组(t(70)=2.33,p=0.0229,计划后续实验比较)。在刺激期间,阳极组的点击速度在数值上高于对照组(图S2,t(70)=1.83,p=0.0713)。因此,阳极刺激不仅与阴极刺激相反,而且在绝对值上促进学习。正确序列数量的Bayes因子分析提供了适度的证据来支持阴极刺激和对照之间没有差异(BF01=3.54)。一般来说,正如预期的那样,无刺激条件介于阴极和阳极条件之间(图6)。我们没有对这些次要结果进行统计测试,因为该研究无法解决这些事后比较。
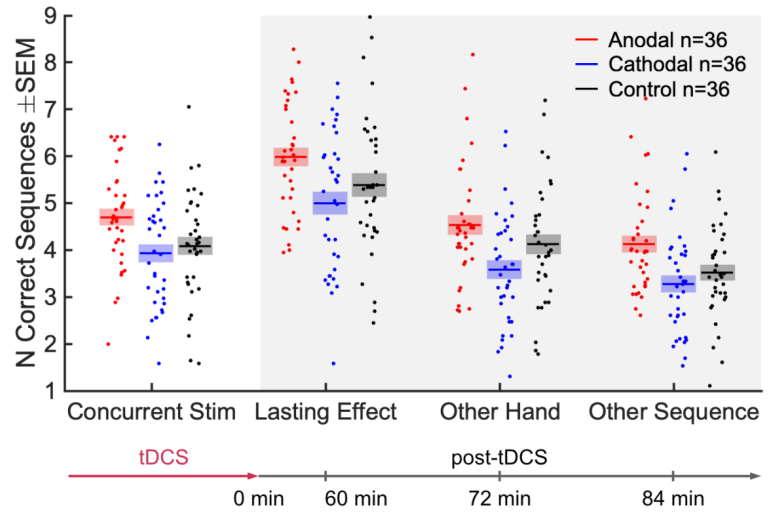
学习收益使得在新的学习任务中提高了原始的表现
到目前为止,我们已经分析了整个12分钟训练期间的平均性能,因此没有区分初始表现的增益与学习新序列的额外增益。因此,我们测试在12分钟后续测试开始时是否已经存在延滞效应(图S3)。为了验证这一点,我们对初始表现进行了双向方差分析,并考虑了条件因素(持久效应,另一方面,其他顺序)和极性因素(阳极,阴极)。我们发现,正确序列的初始数量受极性(F(1)=8.6,p=3.7×10-3)的影响,但与任务条件没有影响(F(2)=0.15,p=0.86). 因此,我们发现了对初始表现的非特定延滞效应。
延滞效应是先前实验治疗的任何效应,在实验终止且受试者不再经历治疗后持续一段时间。
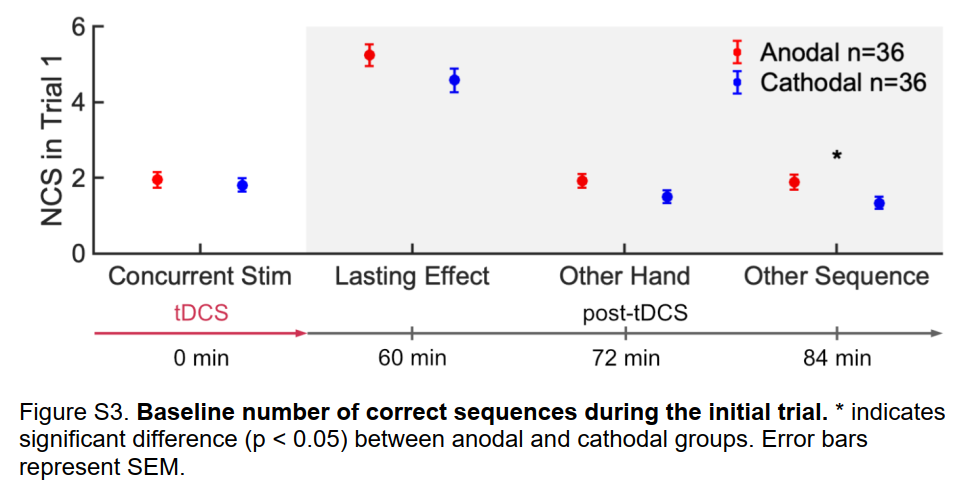
4mA的感觉是可以接受的,并且与积极的调控非常匹配
刺激后问卷记录刺激开始时最多的是中等感觉水平(图7)。之后感觉下降,在试验结束时下降到非常轻微的水平。 阳极组和阴极组之间的感觉评分没有显著差异(BF01=2.59,说明在试验开始时没有差异),这表明阳极组的学习提高不是感觉不同的结果。阴极刺激组和无刺激组之间的表现差异也进一步证明了这一点,尽管感觉上存在很大差异。
4+4配置的估计场强和安全影响
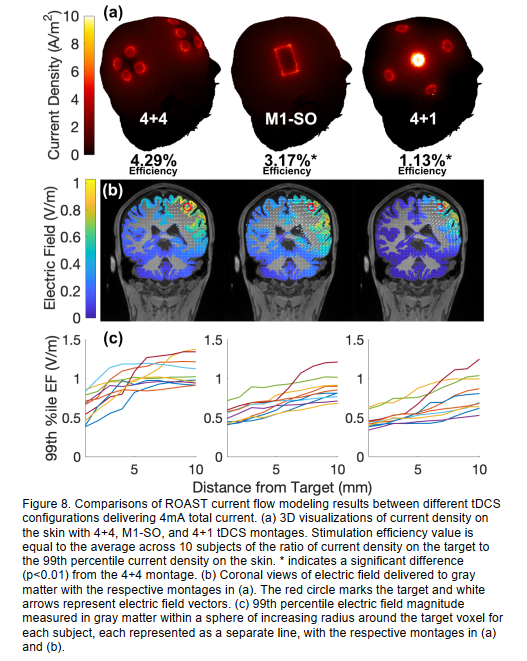
根据电流模型,提出的4+4电极蒙太奇,总电流为4 mA,在被扫描的10个头部上,在“hand-knob”目标处平均获得0.63±0.18 V/m的电场。虽然该值低于先前使用2mA的研究中报告的0.8V/m最大强度,但需要注意的是,这些是整个大脑的最大强度。如日冕图所示(图8b),在4+4蒙太奇下,目标附近灰质中的电场强度可能更大。 在距离目标10 mm半径内,最大场强达到1.1±0.18 V/m(图8c)。我们比较了这种蒙太奇与其他传统tDCS蒙太奇的效果。即M1-SO(C4上的50×30×3mm海绵阳极和Fp1上的阴极)和4+1(C4下的高清电极阳极和F4、Cz、P4和T8上的阴极)。M1-SO配置在目标上达到0.52±0.10 V/m,在10 mm附近达到最大0.87±0.16 V/m。4+1配置分别为0.45±0.096V/m和0.81±0.23V/m。
除了增加电场强度外,新的蒙太奇旨在降低头皮上的电流密度,以最小化皮肤感觉。对于三种配置,头皮层上的最高电流密度分别为4.1±0.17A/m2、4.6±0.27A/m2和11±0.29A/m2(整个头部上的4+4、M1-S0和4+1、99.99百分位,图8a)。因此,提出的4mA蒙太奇至少比临床前研究的安全阈值低一个数量级
量化效率的一种方法是在目标强度和不适之间进行权衡,后者与皮肤上的电流密度直接相关。因此,我们将刺激效率定义为目标电流密度与头皮最大电流密度之比(图8a)。在4.29%,4+4蒙太奇的刺激效率显著高于M1-SO(配对t检验:t(9)=3.8,p=3.9×10-3)和4+1蒙太奇(t(9)=9.3,p=6.7×10-6)。
Discussion
总结结果,阳极刺激改善了运动序列学习,鲁棒效应大小为0.7 。这种效果在刺激之后至少持续1小时。 积极对照条件排除了这是不同感觉水平的结果的可能性。 重要的是,表现差异也反映了阳极刺激比完全不刺激的净性能增益。
感觉分级和建模表明, 在4+4个电极上分布4mA是安全的、可耐受的,并且比传统的tDCS蒙太奇更有效。
在将刺激强度提高到4mA时,我们注意到了与感觉、耐受性和安全性相关的问题。尽管之前的研究已经证明4mA通常具有良好的耐受性,但并非所有这些都能正确解释感觉上的差异。这一点在4mA时尤为重要,因为在4mA处,高强度不再可以忽略。因为带斜坡的传统假刺激只能提供高达1mA的可靠有效致盲,我们使用阴极刺激作为具有类似感觉的积极对照。此外,这些研究在一对海绵或橡胶电极上传输4mA。这里提出的4+4蒙太奇分散电流,每个电极仅通过1mA。这不仅减少了感觉,而且使皮肤处的电流密度最小化,以帮助限制不期望的电化学相互作用。 计算模型分析表明,在4+4蒙太奇下头皮上的最高电流密度小于等效4+1蒙太奇的一半。在4mA时,它仍然比组织损伤阈值(刺激30分钟时为50 A/m2)38低一个数量级。此外,在皮肤上给定的电流密度下,4+4蒙太奇在目标上产生比传统设置更高的场强。使用MRI优化每个个体受试者的4+4蒙太奇可以进一步提高这一效果。 结合中等感觉等级,通过4+4配置的4mA tDCS是安全、可耐受和有效的。
由于早期关于运动皮层兴奋性的报道,运动系统一直是tDCS的常见目标,包括控制各种个体变异源时的强烈影响。然而,行为结果缺乏标准化和再现性。例如,一些研究表明阳极刺激对FTT表现有影响,而其他与运动学习任务相关的研究发现,tDCS对皮层或小脑的影响是混合的。此外,方法学问题使这些研究的解释复杂化,如缺乏对感觉的控制,刺激目标缺乏明确性,样本量小,效果大小不确定。在这里,我们用标准的运动学习范式、感觉控制、电流建模、大样本和结论性效应大小来解决这些问题。
选择FTT的刺激靶点并不总是简单的,因为运动学习是一个复杂的过程,涉及小脑、纹状体、运动前和初级皮质(M1)、辅助运动区(SMA)和脊髓。我们选择以M1为目标,因为学习期间的运动表现与在各种神经成像模式中测量的M1激活标志物的变化相关。在连续的学习过程中,M1也会发生结构变化,反映在灰质体积增加。重要的是,有大量文献证明了tDCS对M1兴奋性的影响,包括纳入运动学习的研究(尽管没有得出结论)。
虽然我们已经发现阳极tDCS对运动学习有相当大的影响,但刺激与学习的确切潜在相互作用尚不清楚。许多模型已经提出,在运动序列学习期间,跨上述不同大脑区域的多个功能连接网络并行工作,并且它们的参与在不同阶段发生变化。值得注意的是,Doyon和Ungerleider描述了皮质-纹状体和皮质-小脑回路的参与和相互作用。这两个系统在快速学习阶段都很活跃,小脑参与协调,纹状体参与序列记忆。根据Doyon等人的说法,在运动序列学习过程中,当适应性功能变得不那么重要时,依赖性从皮质-小脑转移到皮质-纹状体。同时,M1中的活动区域随后增加,并与表现呈正相关,因此M1似乎在任务表征中发挥作用。由于M1中神经元募集的明显变化,刺激M1可能促进这些连接或促进皮质-小脑和皮质-纹状体相互作用。
外显和内隐序列学习之间的区别进一步表明,M1和皮质-纹状体系统在这里使用的FTT中特别重要。FTT被认为是一项显式学习任务,它不仅涉及手指运动序列的自动化,而且首先还要求参与者学习从数字到手指的映射(视觉运动映射)。与序列反应时任务(SRTT)等内隐学习任务相反,FTT中不涉及工作记忆。Aizenstein等人比较了两种学习过程中的功能磁共振成像。研究发现,在外显学习中,序列学习期间的M1活性高于随机按键,而在内隐学习中,序列学习期间的M1活性低于随机按键。他们还发现,视觉皮层、前额叶皮层和纹状体更多地参与外显学习。因此,有可能有意识和明确地“思考”一个序列需要M1,在M1中,它执行动作的逻辑,而小脑细化动作。此外,纹状体的平行激活表明皮质-纹状体系统在外显学习期间比内隐学习期间更活跃。
在初始任务期间,tDCS对微离线增益的影响最大,在间歇训练期间。这种微离线学习被归因于学习的巩固。Buch等人最近表明,正是在休息时间间隔内,人类中枢神经系统“重放”先前练习的任务。在该任务的背景下,练习任务的海马新皮质重放率预测了微离线增益的幅度。阳极组的学习具有更显著的微离线增益,表明阳极tDCS对与此快速重放相关的巩固的影响。在未来评估tDCS效应和神经回放之间的关系将是有趣的。
我们注意到,阳极组的微离线学习增益被负的微在线变化抵消。我们推测在每次试验中更快的初始敲击速度可能会导致手指更快的疲劳。最后,与初始任务不同的是,在所有三组中,在后续的S2和S3任务中,学习主要是微在线学习。微观学习的这种意外转变表明,FTT中的后续训练可能具有不同的潜在机制。这可以用Doyon及其同事的运动学习理论来解释,该理论区分了早期巩固阶段和后期自动化阶段,具有不同的底层网络机制。我们在休息一小时后观察到的变化可能会导致这些早期和后期学习阶段之间的转换。无论如何,这种学习行为转变的观察值得进一步研究,不管tDCS的影响如何。
基于我们以前对DCS的研究结果,本研究通过检查tDCS效应的特异性,进一步扩展了运动学习研究。就tDCS而言,我们观察到了整个休息期的延滞效应。具体来说,学习本身在新的序列和另一只手都得到了提升。 这似乎与我们实验室在突触可塑性方面的体外DCS工作相矛盾,即刺激必须与训练同时进行,并且效果特定于学习任务(H4)。 相反,我们观察到,学习增益随着时间的推移延伸到在没有同时刺激的情况下练习的新运动序列,注意,即使在新序列的基线下,性能也得到了改善。这种非特异性的提升可能适用于更一般的技能,如学习任务的视觉运动映射部分,在这种情况下,我们预计在同一只手的新序列上,基线表现会有所改善。在过去,运动学习后塑性变化的神经标志物仅在经过训练的手上观察到,表明半球特异性(H3)。与此解释一致,我们只看到受刺激手在新序列上的基线表现有后续增益,而非非受刺激手。 相反,尽管我们的目标是只刺激一个半球,但在刺激双手后1小时内,各组在学习新序列方面总体上还是有所改善。我们从中得出两个可能的结论。首先,刺激可能导致元学习的一种形式,即刺激后学习总体上有所改善(至少在我们上次测试学习时长达84分钟)。其次,这种元学习效应并非特定于受刺激的大脑半球,也不是由于视觉运动映射的增强,我们本以为视觉运动映射是特定于训练过的手的(因为另一只手的映射不同)。另一个可能导致非特定收益的因素是注意力的持续增强。未来的实验将需要专门设计来区分这些可能性。
对于观察到的tDCS对运动学习的非特异性影响,也可能有方法学上的解释。例如,尽管进行了随机化,我们本可以有一个不均匀的样本,即阳极组的参与者队列恰好是更好的学习者。事实上,由于长期训练(如音乐家)并伴随着灰质体积或密度的增加,运动学习表现在不同的受试者之间可能存在很大差异。然而,对初始表现的定量分析使这种可能性不大。或者,在单盲实验中,实验者可能对参与者引入了非特异性偏见。然而,鉴于给参与者的指示遵循严格的脚本,这似乎也不太可能。在新的双盲参与者队列中重复这项研究可能有助于解决这些问题。
然而,可以安全地得出结论,所观察到的效果并不特定于与刺激同时进行的训练,这表明了更普遍的神经调节机制。 例如,经常有人认为,神经元活性的增加导致BDNF合成和释放的增加,这可能导致可塑性的持续增加,即使在随后的诱导期间也是如此。相反,我们先前假设的DCS效应的介体是膜电位的急性调节,其只能在同时刺激期间作用于突触可塑性。虽然需要体外实验来解决这些细胞和分子机制,但最终我们需要一个可靠的实验方案来测试人类的行为学习效果。没有可靠的复制,就没有科学。我们希望,本文提出的方案将被其他实验室独立复制,从而为经颅电刺激科学的进步提供坚实的垫脚石。



