刺激蒙太奇实现聚焦性和强度的平衡
1. 摘要
经颅直流电刺激(tDCS)是一种非侵入性神经调节技术,通过使用恒定的低电流刺激目标皮层区域来治疗大脑疾病。与使用两个大焊盘电极的传统TDC相比,多电极TDC最近受到了更多的关注。它能够在刺激强度和焦点方面实现更好的刺激性能。在本文中,我们首先建立了tDCS的计算模型,然后提出了一种新的优化算法,使用正则化矩阵l来探索刺激强度和焦点之间的平衡。仿真研究的目的是通过定量评估来比较最新算法和所提算法的性能。结果表明,该算法不仅达到了预期的强度,而且目标误差小,聚焦性好。鲁棒性分析表明,在头皮和脑脊液(CSF)电导率范围内,结果稳定,而颅骨电导率最为敏感,在实际临床应用中应慎重考虑。
Introduction
作为一种非侵入性神经调节方法,经颅直流电刺激(tDCS)显示出治疗许多大脑疾病和改善大脑功能的潜力,如抑郁症、癫痫和帕金森病。它也引起了人们极大的兴趣,因为它也可能有益于健康的个人。传统的TDC通过两个大电极板施加恒定的低直流电来刺激特定的大脑区域。在不干扰大脑其他区域的情况下,实现特定区域的精确激活或抑制是一个挑战。
为了改进这一有前途的技术,人们做出了许多努力,例如使用多个电极来实现聚焦脑电图引导刺激。例如,具有256个通道的GTEN系统(EGI、Eugene或美国)集成了互易定理和基于EEG的源定位工具,如sLORETA。这些基于互易原理的方法以观察到的EEG模式为指导,以最大化目标处的方向电场。然而,它们有许多不足之处。首先,更新的源定位算法(如gFOTV)可以提高定位精度和聚焦度。此外,电极系统的密度确实会影响刺激结果,256可能不足以达到稳定。最大的缺点是互易定理可能不理想,尤其是在多目标情况下。它可以刺激这些靶点的平均位置,并产生广泛分布的刺激模式。因此,将高密度电极系统用于TDC的新挑战之一是确定每个电极上的最佳电流。一个最佳的电流模式将使多电极系统能够提供高聚焦、高精度和高强度的刺激。
到目前为止,基于优化的方法是分配注入电流值最常用的解决方案。作为一个超定问题,最小二乘解是一种简单的方法,它可以最小化二阶误差项。考虑到临床使用中的安全问题,在应用该算法时加入了约束条件;因此,它可以称为约束最小二乘法(CLS)。其最佳电流模式通常产生相对集中的刺激,但刺激强度较低;一种可能的解释是,与整个大脑相比,目标区域通常很小。
为了克服这一挑战,对最小二乘法进行了改进,在一种称为加权最小二乘法的技术中,通过分配权重来平衡微小的目标区域和较大的非目标区域。它能够产生更高的刺激强度;然而,权重因子必须由临床医生给出,这是一项非常重要的任务。
另一种可能的解决方案是将误差向量的L2范数更改为L1范数方法。L1范数用于实现更多的焦点刺激,因为基于L1范数的保真度项更为稳健,并导致误差分布不均匀,这是我们之前报告的[22]。然而,这在计算上非常昂贵。由于其计算缺陷,我们在本次调查中不探讨使用L1范数的影响。
另一种已开发的技术优化目标区域的强度,称为最大强度(MI)方法。这种方法倾向于实现高刺激强度,但更有可能激活较大的非目标区域。因此,这促使在非目标区域引入更多约束,以改进MI方法。然而,附加约束可能会导致不存在可行解集的情况,并且计算时间更长。
这些改进都表明了这个优化问题背后的关键点,即找到平衡刺激强度和聚焦性的方法。
一个名为线性约束最小方差(LCMV)[20]的新解决方案采用了波束形成问题的思想。该算法有一个硬约束,即目标区域的刺激强度被强制为完全等于所需的刺激强度,而代价函数使非目标区域的能量最小化。该策略旨在确保刺激效果,但存在缺陷。在满足硬约束的前提下,LCMV将对非目标区域的影响降至最低。当目标区域的期望电场难以实现时,它可以极大地牺牲非目标区域并产生分散的电场分布。在最坏的情况下,它甚至可能无法达到硬约束,因此无法给出可行的解决方案。
为了平衡权衡并克服这些缺陷,我们提出了一种结合LCMV和MI原理的新方法。新的方法,即平衡聚焦和强度刺激(SBFI) ,使目标区域的能量最大化,而非目标区域的剩余能量最小。此外,我们还采用了加权最小二乘法的思想,在SBFI中添加了一个刺激参数l,以平衡目标区域和非目标区域的强度和聚焦性。使用上述方法和提出的SBFI方法进行了计算模拟实验。
2. 方法
2.1 框架和计算模型
为了描述这个优化问题,我们将头部视为一个体积传导模型,该模型由多个组织组成,每个组织具有不同的电导率。而且,大脑皮层被分成n个部分,并且大脑皮层的电场表示为$e_{3n×1}$。
电导率的参数设置为:头皮$\sigma_{Scalp}=0.465S/m$、头骨$\sigma_{Skull}=0.01S/m$、脑脊液$\sigma_{CSF}=1.65S/m$、大脑皮层$\sigma_{Cortex}=0.2S/m$
对于有m个电极的仿真系统,我们使用$s_{m×1}$来表示系统的注入电流。本次研究中$m=342$。这种具有更多自由度的高密度电极系统能够提供比低密度系统更好的刺激模式。
电极模型使用SolidWorks构建。为了模拟真实的临床条件,电极具有金属层和凝胶层。
考虑到tDCS应用时头部组织主要是电阻性的,电场分布可以看作是准静态的。在此条件下,使用的电流和电场具有线性关系:
系数矩阵$K_{3n×m}$又称导联场矩阵,提供电极系统注入电流与大脑每个体素处的电场值之间的映射信息。用有限元法求解COMSOL多重物理中的Laplace方程,得到$K_{3n×m}$
2.2 优化模型
为了平衡刺激焦点和强度之间的权衡,平衡焦点和强度的刺激(SBFI)将两者结合在代价函数中。
- 聚焦性由非目标区域的总能量$||D_s||^2$表示。这里,$D$是$K$的子矩阵,与非目标区域的注入电流相关。
- 强度可以被表示为$e_0^TCs$。目标处所需电场强度的分布为$e_0^T·C$,作为$K$的子矩阵,是目标区域电流的系数矩阵。
因此,SBFI的代价函数可以进一步写为:
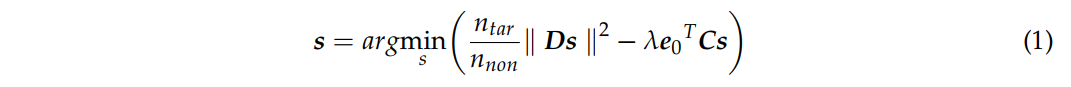
其中,
- $\lambda$是平衡第一项聚焦和第二项强度的优化参数。$\lambda$越大,聚焦度越高;$\lambda$越小,聚焦度越高;在这项工作中,根据参数扫描仿真经验选择$\lambda$。
- 目标和非目标区域的体素数量分别为$n_{tar}$和$n_{non}$
该凸优化问题可以通过CVX等软件有效地求解,从而得到唯一未知的电流模式。
此外,该算法可以扩展以满足在单个刺激会话中针对多个大脑区域的需要。在神经记录技术的指导下,多靶点刺激在阻止癫痫发作的潜在应用中是可取的。
然而,如果考虑到复杂的大脑结构和其他因素,不同靶点的刺激效果可能不尽相同。因此,优化参数$\lambda$可以被进一步定义为$\lambda = diag(\lambda_1,\lambda_2,…,\lambda_{n_{tar}})$
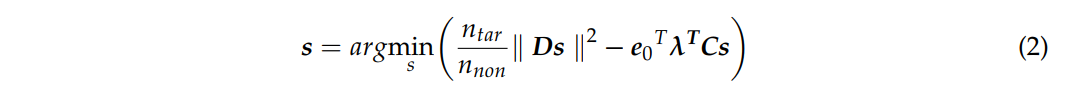
2.3 安全限制
为了保证刺激在安全限制范围内,有必要为优化模型引入约束。一般来说,有三个常见的安全问题。
1、首先,根据电荷守恒定律,所有电流流入的总和应等于所有电流流出的总和。
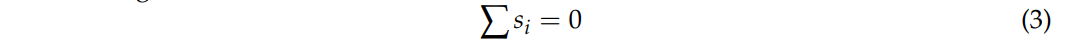
2、其次,注入每个电极的电流不能超过$I_{max}$。避免疼痛和皮肤损伤。
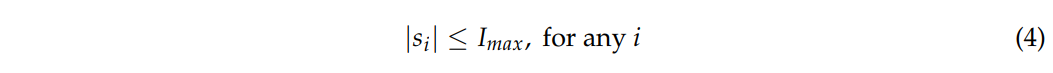
3、最后,限制流入身体的所有电流的总和。使用$I_{total}$来表示注入身体的最大和电流。
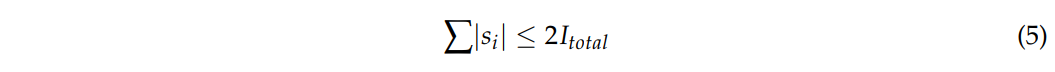
本次研究,$I_{max}=2mA, I_{total}=4mA$,这样是安全的。
优化模型的可行集定义为:
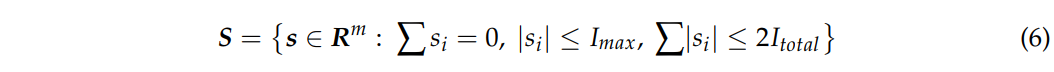
2.4 实验设计
为了测试所提出的算法SBFI的性能,并将其与传统的双电极系统和一些可用的算法进行比较,我们根据不同的临床应用设计了不同的刺激案例。
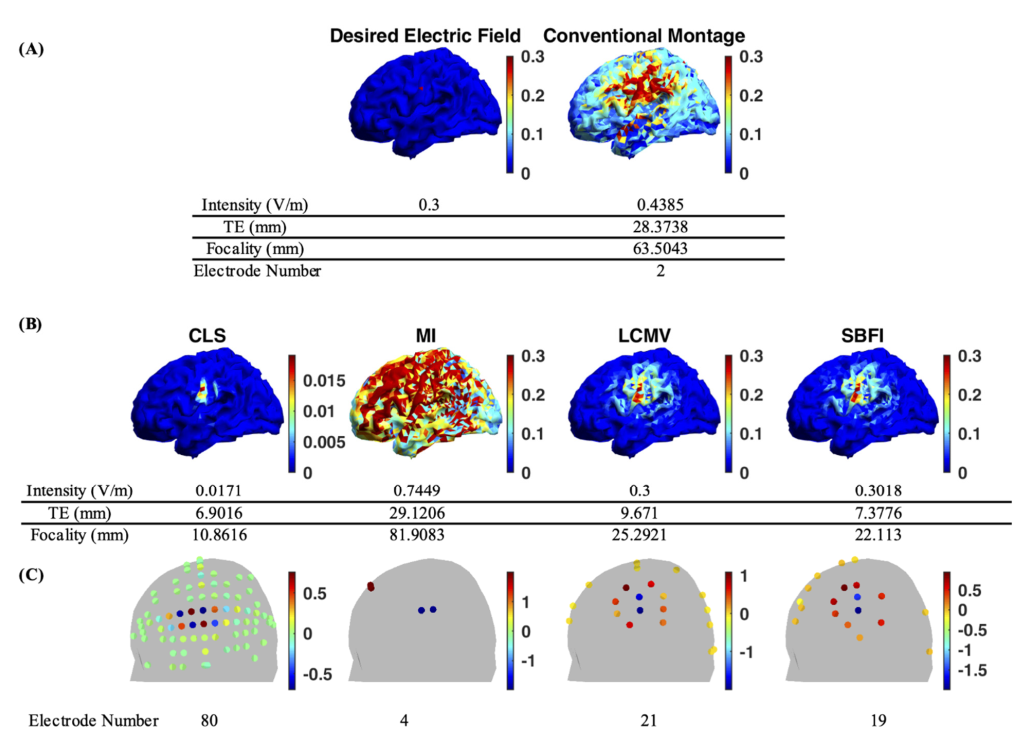
首先,最简单的测试是刺激运动皮层中仅包含一个体素的单个靶点($n_{tar}=1, e_0$的维度为$3×1$,矩阵$C$的维度为$3×m$),所需强度为0.3 V/m(下图),此场景模拟常见的临床用途。
由于传统的双电极系统无法针对多个区域,因此在多目标优化算法的性能比较研究中,它被排除在外。因此,在SBFI、CLS和MI之间进行比较。
单靶点测试的结果:
- (A):理想电场和传统蒙太奇的结果。
- (B):不同优化算法的结果。色标表示电场强度,单位为V/m。(注:除CLS外,各种算法的结果均以相同的标度[0,0.3]V/m显示。0.3 V/m以上的强度为饱和,以便可视化。)
- (C):不同算法计算的电极使用分布。传统的蒙太奇和MI方法使用少量电极产生分散的电场分布。CLS方法可以实现局部刺激,但强度太弱。此外,它需要使用80个电极,这是与其他电极相比的另一个缺点。LCMV和SBFI均成功实现了足够强度的聚焦刺激。SBFI在强度、目标误差和焦距方面略优于LCMV。
第二个测试是刺激从合成数据中得出的多个目标。如下图所示,刺激目标包含三个大脑区域,左额叶(区域1)的最大电场为0.3727 V/m,左枕叶(区域2)的最大电场为0.3522 V/m,左颞叶(区域3)的最大电场为0.2841 V/m。在这种情况下,目标体素指电场强度大于0.05 V/m的体素坐标。因此$n_{tar}=111$,$e_0$的维度为$333× 1$,$C$的维度为$333× m$。
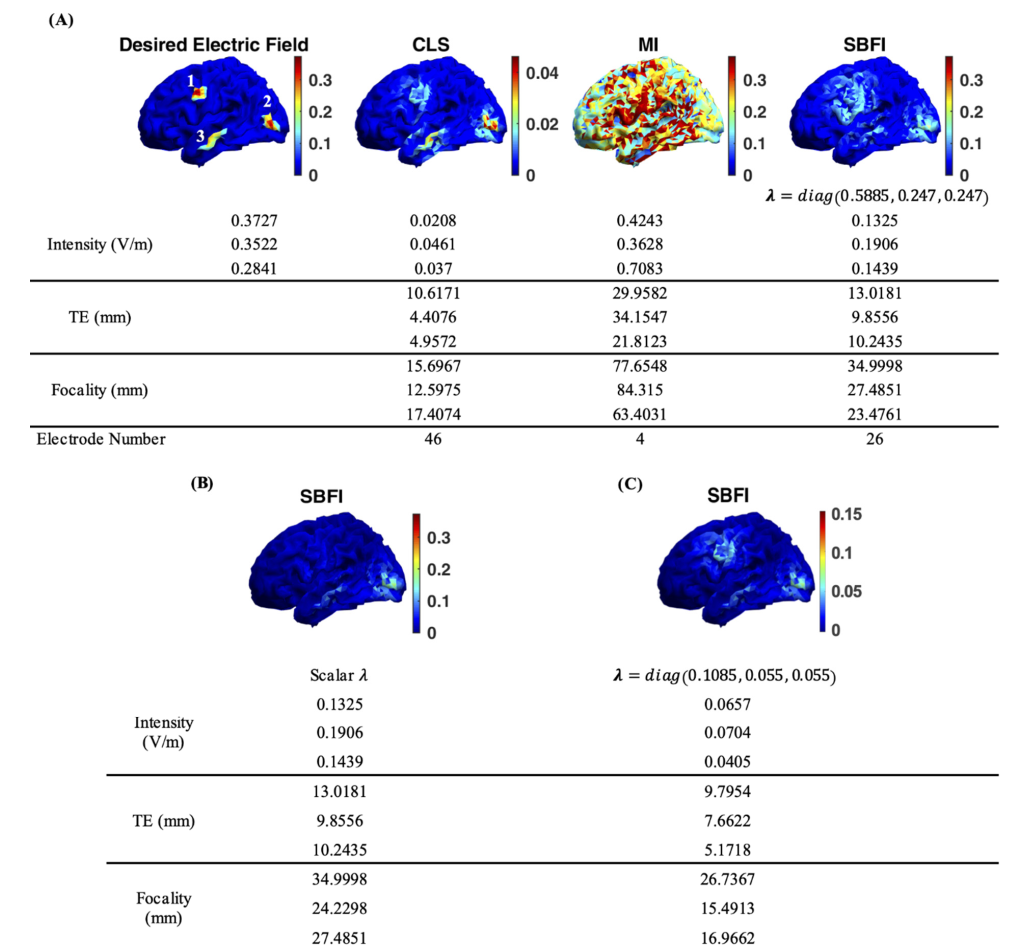
多靶点测试的结果:
- (A):多靶点测试的不同优化算法结果。(注:除CLS外,各种算法的结果均以相同的标度[0,0.3727]V/m显示。0.3727 V/m以上的强度是饱和的,以便可视化。)。CLS算法的结果强度太弱;MI方法似乎激活了整个左半球;只有SBFI才能在刺激强度、精确度和准确性之间提供良好的平衡,LCMV无法找到多目标情况的有效解决方案。
- (B):单$\lambda$靶向合成多脑区SBFI的电场分布模式;
- (C):采用不同$\lambda$靶向合成多脑区SBFI的电场分布模式。
第三个测试测量了每种算法如何处理癫痫患者的真实EEG数据。通过脑电源定位识别目标区域。除了检查真实癫痫数据中多个目标的SBFI性能外,本研究还证明了我们的方法在EEG引导的脑刺激中的适用性。与合成案例类似,EEG-guided案例中有三个目标区域,如图所示。一个位于枕皮质(区域1),最大电场为0.1107 V/m,而另外两个位于左侧和右侧前额叶(区域2和区域3),强度分别为0.0702 V/m和0.0844 V/m。
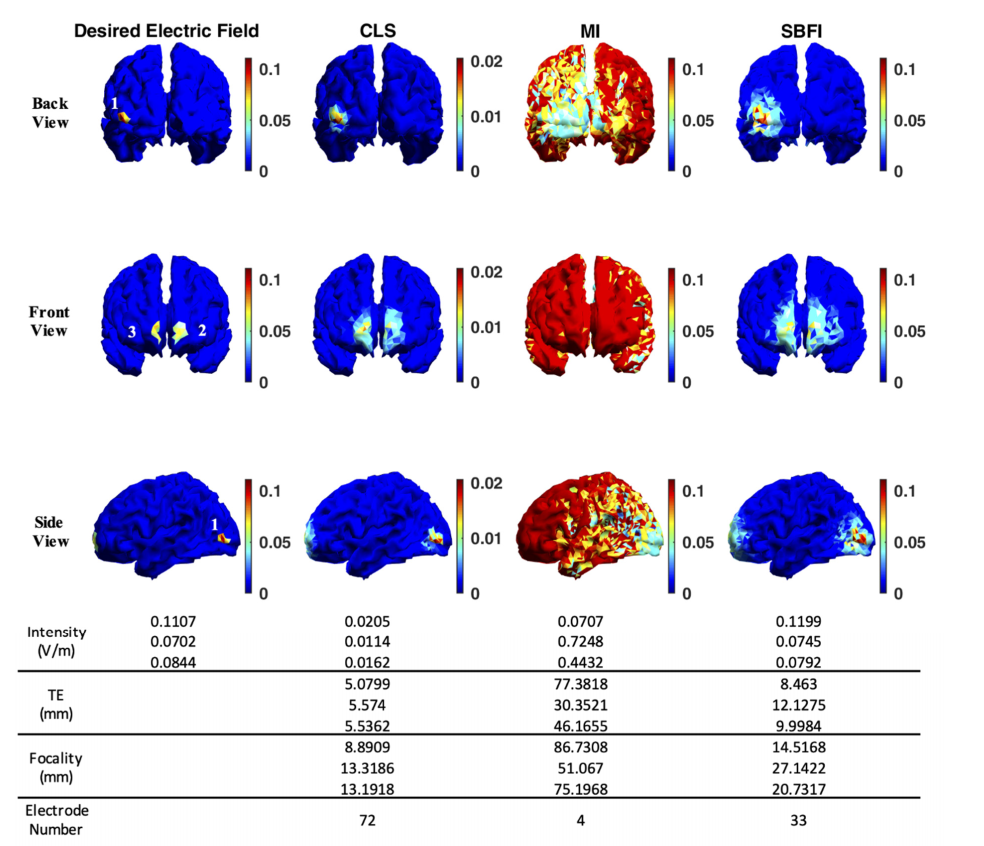
针对实际多目标的不同优化算法的结果。(注:除CLS外,不同算法的结果均以相同的标度[0,0.1107]V/m显示。0.1107 V/m以上的强度是饱和的,以便可视化)。同样,CLS方法的强度太弱,而MI方法几乎激活了整个大脑。只有SBFI在刺激强度、精确度和准确性之间提供了良好的平衡。LCMV方法无法找到一个有效解决方案。
在现实世界中,组织电导率的不确定性可能导致与我们预期的理想模型不同的电场分布;这将极大地影响计算模型的稳健性。 不同的电导率会导致不同的系数矩阵$K_{3n×m}’$;相应的,对于相同的电流模式$s_{m×1}$,电场强度向量$e’_{3n×1}=K’_{3n×m}s_{m×1}$将不同于标准电导率值下的电场分布。$e’_{3n×1}$和$e_{3n×1}$的差异程度反映了计算模型的鲁棒性。
在本研究中,我们观察了组织电导率的微小变化如何在$e’_{3n×1}$和$e_{3n×1}$之间产生差异,从而分析了我们模型的稳健性。我们假设主要组织的电导率以S/m为单位均匀分布。
一个综述了采用不同算法的单个和多个目标,以说明电导率变化的一般影响。正文中以SBFI单靶刺激为例,揭示了具体的影响。
2.5 评价指标
定量评估用于测量和比较所提出方法与其他最先进方法的性能。
首先,刺激强度(单位:伏特/米)由目标区域的最大电场量化。一般来说,更高的强度是首选。强度为0.1~0.3v/m是有效的。
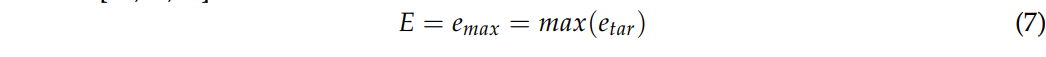
其次,目标误差(target error, TE)定义为目标质心与解区域之间的欧氏距离。
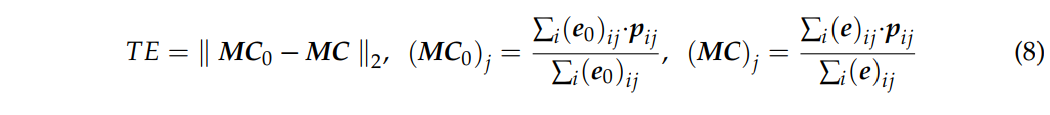
$p_i$代表第$i$个体素的坐标。靶区和激活区的质心分别为$MC_0$和$MC$。$TE$以毫米为单位,是一种评估刺激精确度的方法:$TE$越小,精确度越高。
第三是聚焦性,单位为毫米,由累积能量占总能量一半的半径表示。如果我们使用$\Gamma (r)$表示距离目标区域中心$r$内的体素集,$E(r)$是$\Gamma (r)$的能量部分。聚焦度表示刺激精度。r0.5的较小值表明,大部分能量集中在较小的区域,因此偏离目标的大脑区域不太可能被激活。
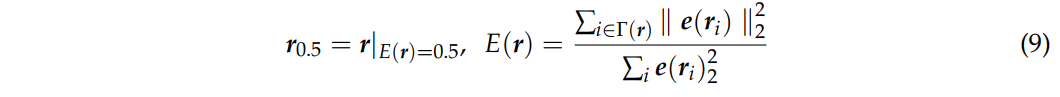
此外,尽管所有优化算法都应用于上述342电极系统,但绝对电流小于1µA的任何电极都被视为失活的,并且提供了蒙太奇中激活电极的数量。为避免混淆,本文其余部分中不同优化方法的“电极数”指的是绝对电流大于1µA的电极数。
在测量模型鲁棒性时,采用均方误差(MSE),即常见的图像测量,来评估$e’_{3n×1}$和$e_{3n×1}$之间的差异。MSE越高,表明电场分布对电导率变化越敏感,因此计算模型对电导率不确定性的鲁棒性越差。
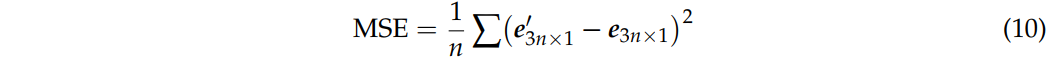
然后对$e’_{3n×1}$和$e_{3n×1}$的电场强度$(E’)$,目标误差($TE’$)和聚焦性$focality’$进行比较。$\Delta E,\Delta TE$和$\Delta focality$可以通过$|E’-E|,|TE’-TE|,|focality’-focality|$分别获得。最后,将给出最大变化率,由不同指标的最大$\Delta E/\Delta \sigma, \Delta TE/\Delta \sigma, \Delta focality/\Delta \sigma$ 定义。
3 结果
3.1 对单靶点的研究
图1 A、B中单个目标的电场分布结果显示了使用多个电极代替具有两个大电极的传统系统的优势。图1 C显示了通过不同算法计算的电极配置。
传统蒙太奇产生的最大电场为0.4385 V/m,焦距为63.5043 mm。图中清楚地表明,这种分散分布不仅激活了运动皮层中的目标,而且还激活了整个左半球。28.3738 mm的目标误差表明,传统的蒙太奇也不能产生准确的刺激。
MI算法的性能与传统蒙太奇算法相似,电场强度更高,焦距和精度更差,这是意料之中的。MI方法使目标处的强度最大化,达到0.7449 V/mm,仅使用四个电极。虽然它的强度是传统系统的1.5倍以上,但它会影响更大的大脑区域,尤其是额叶。焦距和目标误差分别为81.9083 mm和29.1206 mm。
CLS方法与MI算法和传统蒙太奇方法的结果相反。在所有方法中,CLS产生了极其精确的刺激模式,焦距为10.8616 mm,目标误差小于1 cm。然而,CLS的结果强度大约比期望值低17倍。如此低的强度在临床上可能无效。此外,这种蒙太奇需要80个电极,与其他方法相比,这带来了额外的缺点。
对于LCMV和提出的SBFI方法,图1显示了这两种方法的性能具有可比性。两者都成功地在大约20个电极的MI和CLS算法之间找到了平衡。在目标区域达到所需的0.3 V/m强度,同时焦距和目标误差在控制范围内。LCMV的焦距为25.2921 mm,目标误差为9.6710 mm。$\lambda$=0.0316的SBFI方法在聚焦度为22.1130 mm,目标误差为7.3776 mm时略好。与传统的蒙太奇和MI算法相比,这些在焦距和目标误差方面的显著改进表明,更多的能量集中在目标点周围的较小区域,这保证了更有效和安全的刺激。
3.2 对多靶点的研究
当刺激不连贯的目标区域时,传统的双电极蒙太奇不再可行,使用多电极系统是唯一合理的方法。因此,多目标研究排除了传统系统,仅对不同的优化方法进行比较。 值得指出的是,LCMV在单目标情况下表现合理,但由于硬约束,LCMV方法在我们研究的多目标情况下没有可行的解决方案集。因此,我们无法将LCMV的性能与所有其他方法进行比较。没有可行的解决方案是LCMV方法的主要缺点,这促使我们提出SBFI模型。
合成多目标的期望电场分布如图2A所示。
- 与单靶研究的结果类似,CLS可以模拟预期结果的电场分布模式,但所有三个区域的强度几乎都比预期值小一个数量级。在如此低的强度下,刺激的有效性值得怀疑。
- 相反,MI方法在这三个区域产生足够高的刺激强度,但牺牲了聚焦性。从分布图上很难识别出三个离散的区域;MI方法似乎激活了整个左半球。
- 对于建议的SBFI方法,$\lambda=diag(0.5885,0.247,0.247)$可同时实现有效和精确的刺激。所有三个区域的强度都高于0.1 V/m,这足以引起皮质变化。虽然这三个区域的聚焦度值相对高于CLS,但目标区域外的能量实际上低于阈值,这反过来又无法激活神经元。因此,这是一个可以接受的折衷方案,可以看到焦距值的微小增加。
总体而言,建议的SBFI方法在刺激强度、精确度和准确性之间提供了良好的平衡。它不仅可以像MI方法那样提供足够的刺激强度,而且能够同时最小化目标误差和聚焦。
图2B显示了使用标量$\lambda$的SBFI结果。很明显,标量$\lambda$无法平衡三个目标区域。所有三个目标区域的期望强度相似,但运动皮质区域的结果强度远低于其他两个区域。看来该系统不利于运动皮层区域的目标。
一种可能的解释是目标区域的大小。直观地说,系统更容易刺激大区域而不是小区域,因为需要较少的电极来最小化周围非目标区域的强度。如果目标大小定义为目标体素和目标质心之间的最大距离,则运动皮质目标的大小为12.9444 mm,是三者中最小的,而枕叶为13.6425 mm,颞叶为17.7783 mm。
因此,为了补偿这种不平衡的大小分布,我们必须为不同的目标区域分配不同的$\lambda_i$。
图2A中的结果清楚地表明,所提出的SBFI方法可以通过微调优化参数$\lambda=diag(\lambda_{motor},\lambda_{occiptal},\lambda_{temporal})$在强度和聚焦性之间实现合理的平衡。这种灵活性允许系统根据不同的应用实现不同的优化结果。减小$\lambda$的值将增加控制聚焦性的第一项$||D_s||^2$的权重。结果总是具有更好的聚焦性和较低的目标误差,但强度相对较低。例如,当选择$\lambda =diag(0.1085、0.055、0.055)$时,算法有利于聚焦。如图2C所示,焦距和目标误差优于图2A中SBFI的情况,但强度较低。与CLS相比,SBFI在所有三个目标区域都达到了最高的强度,而在相同的聚焦和目标误差水平下。从数学上讲,增加$\lambda$的值可以使第二项占主导地位,而代价函数更接近MI方法。当l接近无穷大时,SBFI等价于MI算法。如果$\lambda$减小,则第一项将得到优化,因为此时代价函数主要使非目标区域的能量最小化。
EEG-guided的多靶点研究也得到了类似的结果,这简单地证明了我们提出的方法适用于解决临床需求,如图3所示。
- CLS可以保持电场的分布形式,但始终无法达到足够的强度。MI无疑达到了所需的强度,但高强度是以刺激的聚焦度和准确性为代价的。
- 这个EEG-guided例子表明,MI甚至会影响两个半球,这可能是因为两个半球都有目标。值得指出的是,CLS和MI产生两个极端:MI有利于目标的强度,而CLS产生更多的焦点刺激。
- 然而,只有SBFI才能平衡所有目标区域的强度和焦点之间的权衡。通过选择合适的优化参数$\lambda=diag(0.147、0.1049、0.1049)$,SBFI在所有三个目标区域都能达到所需的强度,且具有合理的焦距和目标误差。
3.3 鲁棒性研究
我们研究了我们的模型对电导率值变化的鲁棒性,包括头皮电导率、颅骨电导率、脑脊液(CSF)电导率和大脑皮层电导率。由于患者之间这些组织的电特性可能略有不同,我们使用术语“电导率不确定性”来描述在鲁棒性研究期间对模型参数所做的微小变化。
3.3.1 电导率不确定性的总体影响
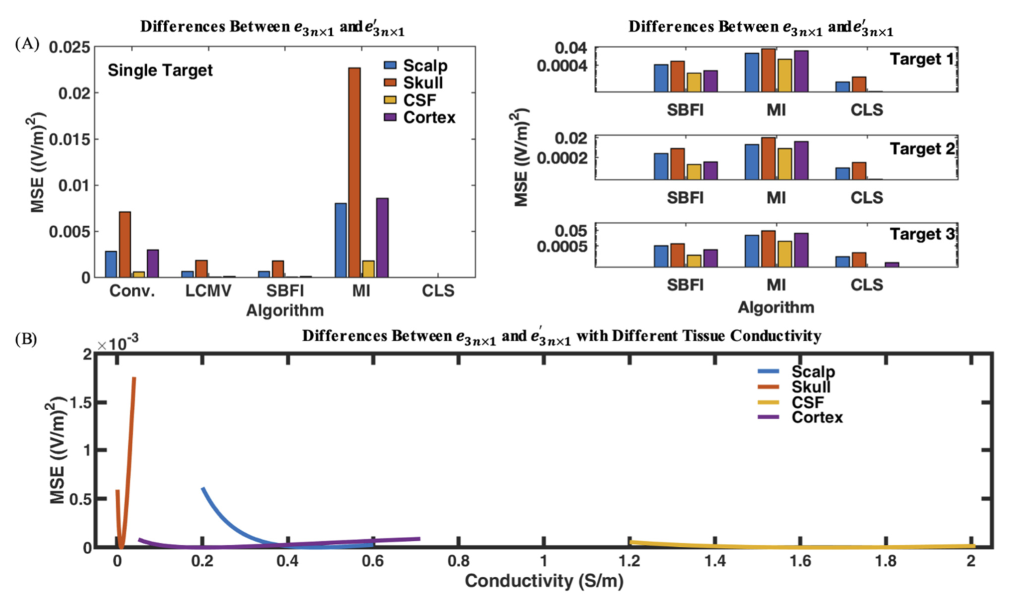
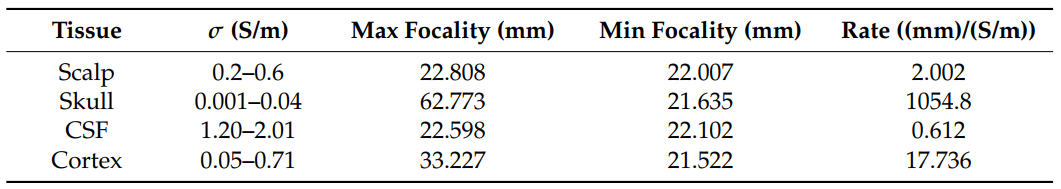
- (A):由于电导率不确定性导致的期望电场$e_{3n×1}$和实际电场$e’_{3n×1}$的MSE。对MSE的影响程度:颅骨>头皮≈皮质>脑脊液CSF。
- (B):各层电导率分布范围内的MSE变化示例。当组织的电导率等于模型中该组织的原始电导率时,均方误差很小。然而,当我们将组织的电导率从其起始值移开时,误差会增加。上图中较大的斜率表明对电导率变化的敏感性较高,因此对不确定性的鲁棒性较低。在可能的电导率变化范围内,模型对颅骨最敏感,对脑脊液最不敏感。
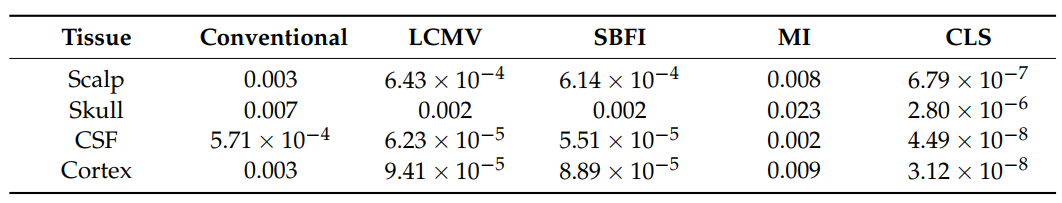
图4 A和表1显示了由于每个算法的电导率不确定性而导致的最大MSE。在所有病例中,均方误差峰值出现在颅骨层,谷值出现在脑脊液层。这些一致的峰谷表明颅骨电导率对模型稳健性的主要影响, CSF对模型稳健性的影响较小。头皮层和皮质层对MSE有相似的中间效应,这表明头皮和皮质总体上具有可比和中等的影响。
3.3.2 电导率不确定性对强度的影响
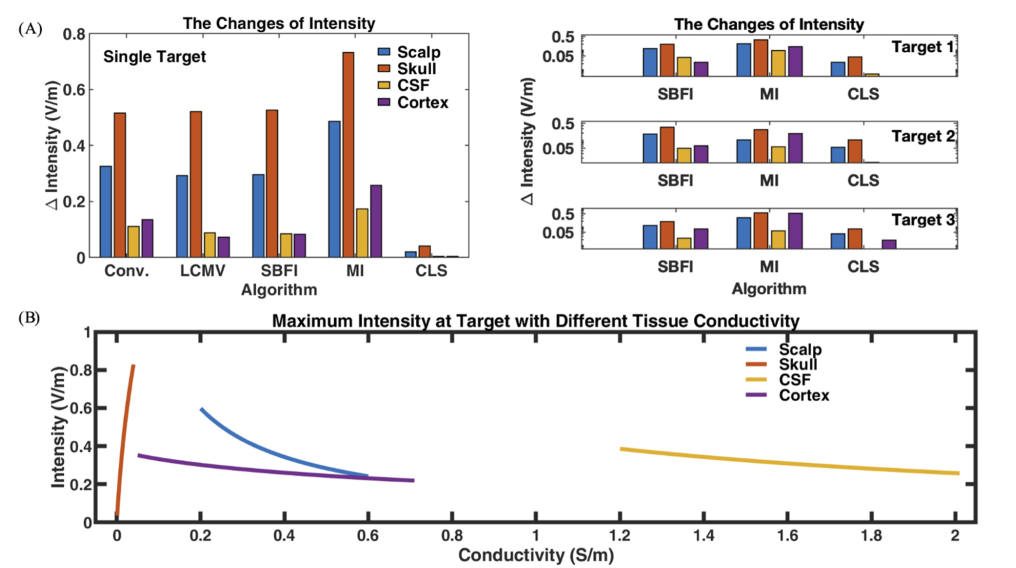
- (A):电导率不确定性导致的最大强度偏离预期值。对强度的影响程度:头骨>头皮层>脑脊液≈皮质层
- (B):强度变化示例。上图中较大的强度跨度表明电导率变化的强烈影响。在可能的电导率变化范围内,颅骨电导率的增加会大大增加强度,而头皮/脑脊液/皮质的电导率增加会降低强度。
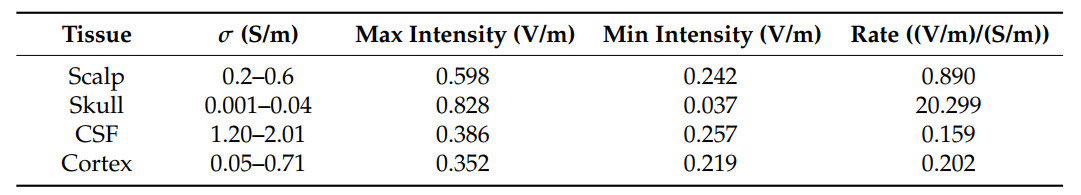
图5和表2显示,颅骨的电导率不确定性对电场强度的影响最大。图5B显示了使用SBFI方法在单靶实验中进行强度分析的示例。颅骨电导率的增加导致靶区的强度急剧增加。 相反,靶区的最大强度与头皮、脑脊液和皮质的电导率呈负相关,头皮对其的影响比脑脊液和皮质强。对这种趋势的一种可能解释可能与电导率范围有关。
3.3.3 电导率不确定性对目标误差的影响
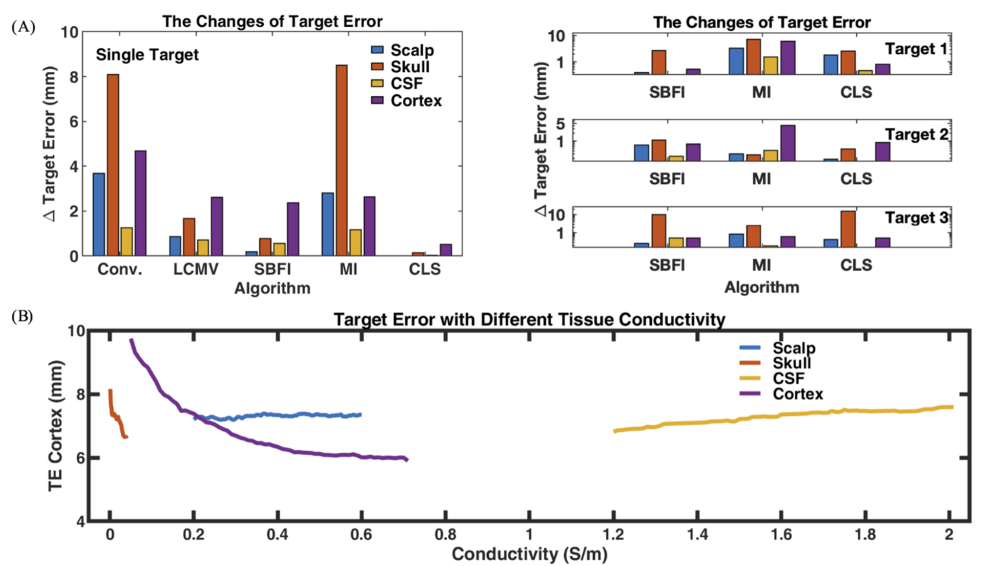
- (A):电导率不确定性导致目标误差与预期值的最大偏差。对目标误差的影响程度:颅骨>皮质层>头皮>脑脊液;
- (B):目标误差变化示例。TE具有非单调和发散的变化形式。(注意:y轴从4 mm开始。)总的来说,当颅骨/皮质电导率增加时,TE趋于降低,而头皮/脑脊液没有明显的趋势。皮层引起的TE跨度最大,这表明皮层电导率对TE有很大影响。
3.3.4 电导率不确定性对聚焦性的影响
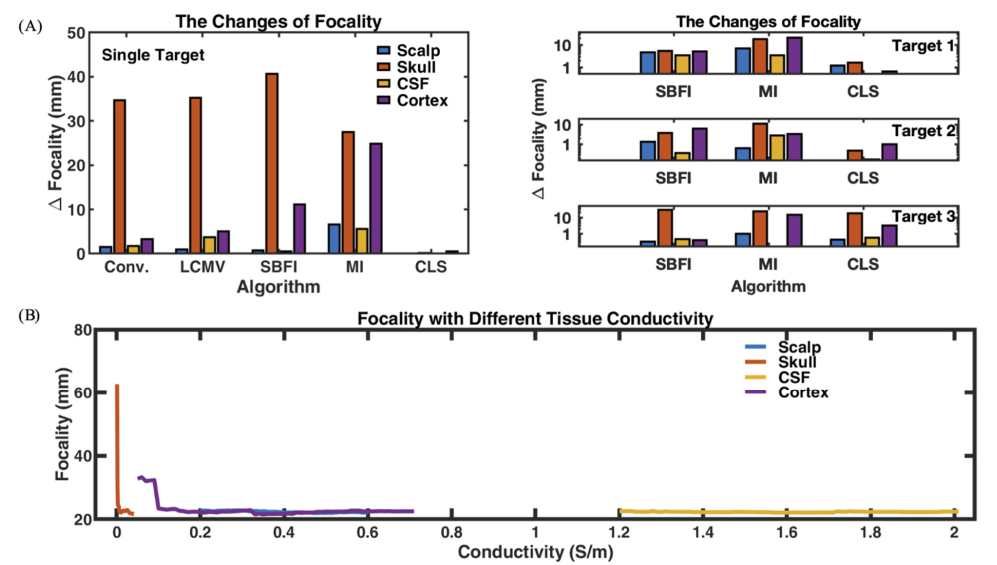
- (A):电导率不确定性导致的最大聚焦偏离预期值。对聚焦性的影响程度:头骨>皮质层>脑脊液≈头皮;
- (B):聚焦性变化示例。(注意:y轴从20mm开始。)聚焦性变化趋势不明显。大多的聚焦性变化会在头骨电导率很小时发生。
4. 讨论
4.1 电极配置
所有研究的电极配置清楚地表明,MI始终使用四个电极,其中两个用于刺激,另外两个用于电流返回。两个刺激电极将大部分电流输送到目标,以增加强度。然而,由于注入电流总量的安全限制,不能使用备用电极来中和非目标区域的影响。这就是为什么MI通常具有较差的焦距和较大的目标误差。
相比之下,CLS比任何其他方法都需要更多的电极。这些电极相互抵消以消除非目标区域的影响,这解释了所有CLS结果的良好聚焦性和较小的目标误差。
由于每个电极只能提供较小的电流以满足总电流的安全约束,因此大量电极也会导致低强度。
因此,策略是保持电极数量既不太大也不太小,这是SBFI的独特方法。从某种意义上说,一些电极提供足够的电流以确保所需的强度,而另一些用于减少非目标大脑区域的不必要影响。
4.2 单$\lambda$和多$\lambda$正则化
如结果部分所述,通过采用$\lambda=diag(\lambda_1,\lambda_2,…,\lambda_{n_{tar}})$可以同时执行平衡每个目标。将一个标量$\lambda$扩展到多个$\lambda_i$的动机是,一些目标可能处于主导地位,并且比其他目标更容易受到刺激。
为简单起见,我们目前让同一区域中的所有体素共享相同的$\lambda$。在极端情况下,我们可以为每个体素设置最佳$\lambda_i$。
4.3 $\lambda$的选择
$\lambda$的选择强烈影响强度和聚焦性的结果。通过模拟研究,我们发现,最优$\lambda$因情况而异,因此每个激励问题都不存在单一的固定最优值。因此,关键是确定参数$\lambda$,以获得强度和聚焦能力之间的平衡。当前的选择基于一些扫描仿真和复杂的方法,如双层优化和交叉验证,可用于在不断演变的来源下动态选择$\lambda$进行闭环刺激。 然而,可以通过研究$\lambda$、目标体素数量和目标区域大小之间的关系来获得见解。例如,当仅使用一个体素刺激单个目标时,$\lambda$会更高,而当使用数百个体素刺激多个目标时,$\lambda$会更低。 因此,可以合理地预测最优$\lambda$与目标体素的数量成反比,并相应地调整$\lambda$。
4.4 鲁棒性
这里的鲁棒性测试确定了组织电导率在最佳刺激中的重要作用。通过我们的系统研究,我们研究了不同靶类型和不同算法的多电极刺激对组织电导率变化的影响。总的来说,头皮和脑脊液对刺激强度、靶点误差和聚焦度的影响很小。不幸的是,颅骨和皮质本身的导电性极大地影响了皮质上的电场分布。
这些结果表明需要单独建模,尤其是临床应用的参数设置。 另一种可能的解决方案是构建特定人群的通用模型。例如,儿童、成人和老龄人口的组织电导率变化很大,而他们在自己的群体中可能是稳定的。 此外,还正在研究病理学引起的电导率差异。疾病状态下的电特性变化可能会极大地影响电场分布并改变刺激结果。因此, 应仔细考虑特定疾病治疗的具体模拟模型。因此,需要进行更多的实验来研究不同组织电导率、各种刺激方案、电极特性、电极位置位移、更精确的人头模型等的联合影响。
有趣的是,注意到算法之间的鲁棒性差异,MI方法通常不如其他优化算法鲁棒。在图4、5、6和7A中,传统的蒙太奇方法略优于具有相对较低条带的MI方法,但鲁棒性不如LCMV或SBFI。 LCMV和SBFI对组织电导率的不确定性具有相当的鲁棒性。
5. 结论
在本文中,我们提出了一种新的优化算法:平衡聚焦和强度刺激(SBFI)来支持多电极tDCS。SBFI可以通过使用合理数量的电极来调整优化参数$\lambda$,从而在刺激强度和焦点之间实现平衡。与传统的蒙太奇和其他流行的优化方法相比,SBFI不仅可以获得足够的刺激强度,而且可以最小化目标误差,同时提高刺激的聚焦度。一系列模拟实验显示了其在不同临床应用中的潜力,尤其是对多个靶点的刺激。该方法的一个局限性是优化参数$\lambda$与问题相关。在上述讨论中,我们概述了将在不久的将来探索的可能解决方案。此外,在鲁棒性研究中,所提出的方法SBFI对不同的组织电导率变化表现出良好的鲁棒性。在测试的算法中,SBFI与整体电场分布的偏差相对较小,目标区域的强度变化较小。鲁棒性实验进一步表明颅骨电导率变化的高影响,这需要在建模研究和临床实施中更多考虑。



